До невідкладних станів у гінекологічній практиці відносяться захворювання, які вимагають надання негайної допомоги.
Одним з найчастіших симптомів захворювання, який вимагає надання недкладної допомоги, є біль. Він виникає внаслідок подразнення серозних покривів, спазму гладкої мускулатури порожнистих органів та порушення кровообігу у внутрішніх органах. Біль в животі може бути зумовлений багатьма захворюваннями: порушеною трубною вагітністю, апоплексією яєчника, перекрутом ніжки пухлини яєчника, некрозом міоматозного вузла, запальним процесом в придатках матки, гострим апендицитом, гострим панкреатитом, перитонітом, печінковою або нирковою колікою, непрохідністю кишечника, тромбозом мезентеріальних судин і т.д. Наступним проявом захворювання, що вимагає невідкладної допомоги є кровотеча. Зовнішня кровотеча може бути зумовлена самовільним абортом, підслизовою фіброміомою матки, внутрішнім ендометріозом, дисфункцією яєчників, розпадом злоякісної пухлини матки. Внутрішня кровотеча у більшості випадків пов'язана з порушеною трубною вагітністю або апоплексією яєчника. Іноді кровотеча є проявом екстрагенітальних захворювань.
ПОЗАМАТКОВА ВАГІТНІСТЬ
Позаматковою (ектопічною) вагітністю називають розвиток зародка поза матковою порожниною. Найчастіше вона локалізується в матковій трубі - (97,7 %). Абдомінальна вагітність зустрічається в 1,37 %, цервікальна - в 0,77 %, яєчникова в -0,15 % усіх випадків позаматкової вагітності. Інтралігаментарна ектопічна вагітність в 1:8400 вагітностей.
Трубна вагітність здебільшого локалізується в ампулярній ділянці (82 %), рідше в істмічній (15 %)та в інтерстиціальній (3 %) ділянках (рис. 11.1).

Рис. 11.1. Локалізація позаматкової вагітності (схема). 1 - інтерстиціальна трубна вагітність; 2 - істмічна трубна вагітність; 3 - ампулярна трубна вагітність; 4 - трубно-яєчникова вагітність; 5 - яєчникова вагітність; 6 - трубний аборт; 7 - первинна черевна вагітність.
Описано випадки одночасно маткової та позаматкової вагітностей, частота яких коливається від 0,6 до 4 %. Зустрічаються двобічні трубні вагітності. Позаматкова вагітність може повторюватись в однієї жінки.
Патогенез. В нормі яйцеклітина, вийшовши з яєчника під час овуляції та запліднившись сперматозоїдами, без перешкод просувається вздовж маткової труби. Для цього необхідні дві умови: нормальна анатомічна будова труби та перистальтика її від ампулярної частини до матки. В нормі процес утворення трофобласта, який сприяє імплантації у стінці матки, відбувається тоді, коли запліднене яйце потрапляє в матку. Якщо рух яйця по трубі затримується, то трофобласт може утворитися швидше, ніж яйце потрапить в матку, що створює сприятливі умови для виникнення позаматкової вагітності. Відповідно до овулогенної теорії, нідаційні властивості яйцеклітини проявляються передчасно, коли вона ще не дійшла до порожнини матки, тому нідація відбувається в трубі. При трубній вагітності імплантація плідного яйця відбувається в слизовій оболонці труби, ворсини хоріона проникають в стінку труби, м’язовий шар труби розростається, гіпертрофується, але цього недостатньо, щоб забезпечити оптимальні умови для розвитку плідного яйця, тому на 4-6 тижні трубна вагітність переривається. Переривання вагітності відбувається внаслідок порушення цілості плідного мішка. Якщо він розривається в просвіт маткової труби, плідне яйце гине, відшаровується від стінок труби, яка, скорочуючись, виштовхує його через ампулярний відділ в черевну порожнину. Таке переривання вагітності за типом трубного викидня (аборту) супроводжується кровотечею різної інтенсивності. Кров із маткової труби потрапляє в черевну порожнину, збирається навколо неї, потім спливає в задній дугласів простір. За типом трубного викидня найчастіше переривається вагітність, яка розвивалася в ампулярній ділянці маткової труби.
Якщо імплантація плідного яйця відбулася в істмічній або інтерстиціальній ділянці труби, то порушується вагітність за типом розриву маткової труби, що завжди супроводжується значною внутрішньою кровотечею. Інколи плідне яйце, вийшовши з маткової труби, не гине, а вторинно імплантується в черевній порожнині. Так виникає черевна вагітність.
Причиною ектопічної імплантації є анатомо-фізіологічні зміни, що сприяють затримці плідного яйця в трубі. Однією з причин позаматкової вагітності є довгі, покручені маткові труби з вузьким просвітом та недостатньою перистальтикою при інфантилізмі, додаткові труби або сліпі ходи вздовж труби внаслідок аномалій ембріонального розвитку. Одним з найважливіших етіологічних факторів ектопічної вагітності є інфекційні захворювання в анамнезі, які призводять до запальних та дистрофічних змін в маткових трубах. Ці зміни проявляються у звуженні просвіту, перекручуванні, склеюванні дуплікатур слизової оболонки труби. Запальні захворювання, головним чином післяпологові та післяабортні септичні процеси, складають 60-80 % причин позаматкової вагітності. Одним з основних інфекційних факторів позаматкової вагітності є гонорейна інфекція. Надмірне, часто безконтрольне застосування неспецифічних антибіотиків призводить до неповного вилікування гонореї і може спричинити неповну оклюзію маткових труб. Будь-яке внутрішньоабдомінальне втручання - апендектомія, хірургічні операції на матці, відновна пластика труб - підвищують ризик позаматкової вагітності. Виникнення позаматкової вагітності після стерилізації складає 5-11 %. Наявність у жінок вузлуватої фіброміоми матки, ендометріозу, кістоми яєчника може змінювати анатомічні співвідношення, звужувати просвіт труб і чинити перешкоди на шляху просування плідного яйця до матки та імплантації його в трубі. Інколи причиною ектопічної вагітності може бути тривала лактація, яка супроводжується вираженою інволюцією геніталій та порушенням функції яєчників. У більшості випадків позаматкова вагітність виникає внаслідок поєднання різних факторів.
При прогресуванні ектопічної вагітності в організмі жінки та її статевих органах спостерігаються такі ж зміни, як і під час маткової вагітності. Матка збільшується в розмірах внаслідок гіперплазії та гіпертрофії м’язових волокон, стає м’якою. Слизова оболонка матки трансформується в децидуальну і готова до прийняття заплідненого яйця. Матка збільшується до розмірів 7-8 тижнів вагітності, але пізніше перестає відповідати терміну вагітності. Збільшення матки та розвиток децидуальної оболонки є проявом ендокринних змін, пов’язаних з розвитком заплідненого яйця.
Найбільш істотні зміни відбуваються в матковій трубі. Оскільки слизова оболонка та м’язовий шар розвинені слабо, маткова труба не спроможна до такого ступеня гіпертрофії, як матка, децидуальних змін у слизовій оболонці маткової труби майже не спостерігається, труба не здатна розтягуватися в міру росту плідного яйця. Ворсини хоріону швидко руйнують слизову оболонку труби, проростають м’язовий шар і доходять до серозного покриву.
Клініка. Клінічна картина позаматкової вагітності дуже різноманітна і віддзеркалює патологоанатомічні зміни в організмі хворої. Прогресуюча ектопічна вагітність ранніх термінів супроводжується такими ж змінами, як і при матковій вагітності: затримкою менструації, суб’єктивними відчуттями: (спотворенням смаку, нюху, нудотою, поганим апетитом, емоційною лабільністю), набряканням молочних залоз, ціанозом піхви та шийки матки. При вагінальному дослідженні виявляють збільшення матки, яке не відповідає терміну гестації. У ділянці придатків пальпується овальної форми, ковбасоподібний, м’якої консистенції, неболючий рухомий утвір, розмір якого залежить від терміну вагітності.
При підозрі на позаматкову вагітність хвору необхідно обов’язково госпіталізувати з метою ретельного нагляду та додаткових діагностичних заходів із виявлення ектопічної вагітності.
Клінічна картина при розриві маткової труби досить характерна і виражена. Діагностика не є важкою, особливо при наявності в анамнезі затримки менструації та ознак вагітності. При порушеній ектопічній вагітності є два основних симптоми: кровотеча і біль. Біль спостерігається в 95 % випадків порушеної ектопічної вагітності і є основним симптомом захворювання. Він може бути слабким, сильним, переймоподібним, тупим, локалізується переважно в тому квадранті, де порушена вагітність. При розриві маткової труби виникає раптовий гострий біль, настає втрата свідомості, та з’являються ознаки геморагічного шоку. Біль локалізується в ділянці перерваної вагітності, іррадіює в крижі або до внутрішньої поверхні стегна. Тупий, розлитий біль різної сили, локалізований спочатку в епігастрії та попереку, а пізніше по цілому животу, супроводжує прогресуючу кровотечу та утворення гематоми в дугласовому просторі. Цей біль може поширюватися до міжлопаткової ділянки внаслідок подразнення діафрагми та діафрагмального нерва. Переймоподібний біль виникає при порушенні ектопічної вагітності за типом трубного викидня і свідчить про те, що відбуваються відшарування плідного яйця від стінок труби та його виштовхування з труби в черевну порожнину. Хвора відчуває біль при вагінальному дослідженні під час пальпації заднього склепіння піхви при наявності гематоми в задньому дугласовому просторі навіть тоді, коли крові небагато (“крик заднього дугласа”).
При порушеній ектопічній вагітності кровотеча буває внутрішньою (із пошкоджених через проростання хоріона судин придатків або рогу матки) та зовнішньою (внаслідок відторгнення від стінок матки децидуальної оболонки). Гостра внутрішня кровотеча, залежно від швидкості та кількості крововтрати, проявляється у вигляді геморагічного шоку. Розрив маткової труби або рогу матки спричиняє внутрішньочеревну кровотечу та гострий біль. Хвора втрачає свідомість або відчуває раптову слабість.
Діагностика. Характерні ознаки шоку: паперова блідість шкіри, блідість або ціаноз слизових губ, нігтів, холодний піт, частий і слабкий пульс (до 120 уд і більше), живіт болючий при пальпації, більше з боку розриву труби. Симптом Щоткіна-Блюмберга слабопозитивний. При перкусії визначається притуплення у надлобковій ділянці та віддалених відділах живота. Артеріальний тиск падає, при прогресуванні кровотечі розвивається картина важкого постгеморагічного колапсу. При вагінальному дослідженні матка дещо збільшена, м’яка, рухома (плаваюча). В ділянці придатків визначається пастозність або утвір тістуватої консистенції. Заднє склепіння сплощене або випнуте, різко болюче при зміщенні шийки матки допереду, біль іррадіює в пряму кишку.
При перериванні ектопічної вагітності за типом трубного викидня встановити правильний діагноз значно важче. Ознаки гострої крововтрати здебільшого відсутні. Найчастішими проявами є переймоподібний біль внизу живота, локалізований в ділянці вагітної труби, та кров’янисті виділення з піхви. Біль має нападоподібний характер з різними інтервалами. Інколи бувають короткочасні запаморочення, рідко - втрата свідомості. При вагінальному дослідженні пальпується дещо збільшена матка м’якої консистенції, пухлиноподібний утвір в ділянці придатків болючий при пальпації, малорухомий. При пальпації заднього склепіння піхви та дотику до шийки матки болючість менша, ніж при розриві маткової труби. Виділення з піхви кров’янисті, коричневого кольору, інколи темні, дьогтеподібні, незначні.
Диференційну діагностику позаматкової вагітності необхідно проводити з такими захворюваннями: перериванням маткової вагітності в ранні терміни, загостренням хронічного сальпінгоофориту, апоплексією яєчника, гострим апендицитом.
Одним із найбільш інформативних додаткових методів дослідження при підозрі на порушену ектопічну вагітність є пункція через заднє склепіння піхви. При наявності гематоми в задньому дугласі через товсту голку отримуємо стару темну гемолізовану кров. Якщо крові в пунктаті немає, то це не виключає ектопічної вагітності, оскільки кров із маткової труби через спайки або малу її кількість може не потрапити в задній дугласів простір. Наявність у пунктаті свіжої крові свідчить про проникнення в кровоносну судину.
Діагностика прогресуючої ектопічної вагітності грунтується на поєднанні ультразвукового дослідження та визначення хоріонічного гонадотропіну. Допомагає в діагностиці лапароскопія або кульдоскопія.
Лікування. Позаматкова вагітність підлягає оперативному лікуванню. Тактика лікаря при порушеній ектопічній вагітності полягає в негайній лапаротомії та зупинці кровотечі шляхом перев’язування пошкоджених кровоносних судин. Одним з основних методів лікування ектопічної вагітності є сальпінгоектомія - видалення маткової труби та перитонізація культі круглою матковою зв’язкою (рис.11.2; 11.3; 11.4; 11.5).
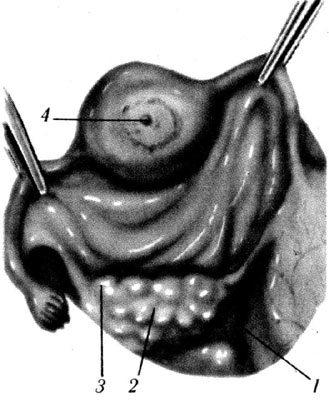
Рис. 11.2. Трубна позаматкова вагітність. Захоплення плідного яйця між затискачами.
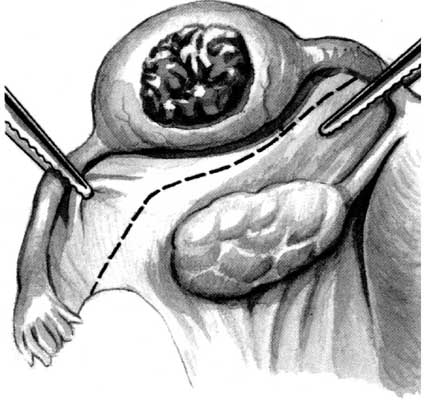
Рис. 11.3. Межі висікання маткової труби.

Рис. 11.4. Резекція маткової труби.

Рис. 11.5. Перитонізація культі круглою матковою звязкою.
В останні роки набуло поширення консервативне лікування трубної вагітності, насамперед у жінок, які не мають дітей або коли одна труба вже відсутня. Консервативну операцію на трубі можна проводити при прогресуючій трубній вагітності або при незначній крововтраті та задовільному стані хворої. До методів консервативних операцій на трубі належать витискання плідного яйця з труби та проведення її кюретажу при локалізації вагітності в ампулярній ділянці труби (рис. 11.6), поздовжній розтин труби, видалення плідного яйця та кюретаж каналу труби, резекцію частини вагітної труби з наступним зшиванням її кінців або імплантацію труби до порожнини матки (рис. 11.7).
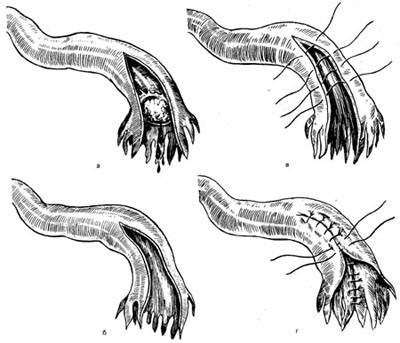
Рис. 11.6. Сальпінготомія при ампулярній трубній вагітності. а - лінійний розріз маткової труби; б - обережне видалення пальцями плідного яйця через розріз маткової труби; в - плідне яйце виділено. Гемостаз; г - накладання першого ряду швів на розсічену ділянку маткової труби; д - накладання другого ряду швів на маткову трубу.
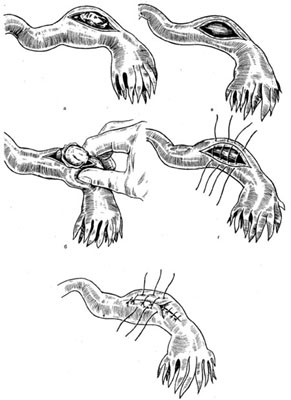
Рис. 11.7. Сальпінготомія при трубному аборті. а - розсічення труби для виділення плідного яйця; б - плідне яйце видалено. Гемостаз; в - накладання першого ряду швів на розсічену ділянку маткової труби; г - накладання другого ряду швів з відновленням цілісності маткової труби.
Такі консервативні операції останнім часом проводять мікрохірургічними методами, які дозволяють виконати пластичну операцію анатомічно з використанням тонких ниток, атравматичних голок та мікрокоагуляторів. Мікрохірургічні операції дають більший відсоток відновлення прохідності маткових труб і збереження генеративної функції. Сальпінгоектомію можна проводити за допомогою лапароскопії. ЛІВОБІЧНА ТУБЕКТОМІЯ Широко застосовують діатермокоагуляцію та лазерну техніку з метою запобігання розвитку спайкового процесу та рубцевих змін маткової труби.
Під час проведення операції з приводу черевної вагітності треба бути готовим до значної кровотечі при видаленні плаценти. Якщо не вдається повністю видалити плацентарну тканину, слід призначити метотрексат 10 мг на добу протягом 5 днів, починаючи з 4-5 дня післяопераційного періоду з метою прискорення деструкції трофобласта.
Профілактика позаматкової вагітності грунтується на запобіганні абортів та адекватному лікуванні хронічних специфічних та неспецифічних запальних захворювань жіночих статевих органів.
Рідкісною, але дуже важливою патологією, є шийкова вагітність (рис. 11.8).
Рис. 11.8. Шийкова вагітність.
АПОПЛЕКСІЯ ЯЄЧНИКА
Апоплексія яєчника - це порушення цілості тканини яєчника і виникнення кровотечі в черевну порожнину. Серед причин внутрішньочеревних кровотеч апоплексія яєчника становить 0,2-0,5 %. Кровотечі з яєчника можуть виникати з його строми, фолікула під час овуляції, фолікулярної кісти, кісти жовтого тіла. В основі патогенезу апоплексії лежать особливості тканини яєчника. В яєчнику відбуваються циклічні зміни: в період дозрівання фолікула судини розширюються, кровопостачання посилюється. В різних фазах менструального циклу змінюється проникність судин. Набухання та легка проникність судин яєчника створюють сприятливий фон для порушення цілості тканини яєчника під впливом деяких зовнішніх та внутрішніх факторів. Апоплексію яєчника можуть спричинити травми живота, оперативні втручання, запальні процеси в ділянці малого таза, бурхливі статеві зносини, нервово-психічні стреси, а також нейроендокринні розлади в організмі жінки, що підтверджується виникненням апоплексії в середині менструального циклу або перед менструацією, коли в крові є велика кількість гонадотропних гормонів.
Клініка. Клінічна картина апоплексії яєчника зумовлена характером кровотечі та супровідними захворюваннями і часто маскується під інші гострі захворювання (позаматкову вагітність, гострий апендицит, панкреатит та ін.)
Гостра апоплексія з вираженою кровотечею у черевну порожнину проявляється сильним болем внизу живота, тахікардією, падінням артеріального тиску, ознаками шоку. Біль має переймоподібний характер, різну інтенсивність (від тупого, ниючого до сильного, нападоподібного), іноді призводить до запаморочення і навіть тимчасової втрати свідомості. Хвора скаржиться на головний біль, загальну слабість, нудоту, блювання, іноді її турбують виділення бурого кольору з піхви. При пальпації живіт здутий, болючий в нижніх відділах. Бімануальне дослідження дає змогу виявити болючість заднього склепіння піхви, при значних кровотечах в черевну порожнину - випинання заднього склепіння піхви. Матка має нормальні розміри, щільну консистенцію, іноді дещо збільшена. ЇЇ придатки збільшені, болючі, при значній кровотечі чітко не пальпуються. За ступенем важкості (А.В. Вербенко) апоплексія яєчника поділяється на три групи: легку, середню і важку. Легка форма проявляється болем помірної інтенсивності внизу живота, нудотою, слабкістю. Шок та перитонеальні ознаки відсутні. При середньому ступені важкості хвора скаржиться на загальну слабість, нудоту, блювання, іноді відмічається втрата свідомості, турбує сильний біль внизу живота і в пахових ділянках, визначаються тахікардія, блідість шкіри, ознаки шоку І ступеня. При пальпації живота слабовиражені перитонеальні явища. Хворі з апоплексією важкого ступеня відчувають постійний різкий біль внизу живота з іррадіацією в крижі та пряму кишку, їх турбують нудота, блювання, здуття живота. Спостерігаються ознаки шоку ІІ - ІІІ ступенів: блідість шкіри, холодний піт, зниження температури тіла, приглушення серцевих тонів, частий, слабкого наповнення і напруження пульс, падіння артеріального тиску. При пальпації виявляють перитонеальні ознаки, френікус-симптом, при перкусії - притуплення звуку в нижніх та бокових відділах живота, при бімануальному дослідженні - випинання заднього склепіння піхви. Пальпувати матку тяжко через різку болючість заднього склепіння піхви.
Діагноз апоплексії встановлюють на основі даних анамнезу, об’єктивного обстеження: пальпації та перкусії живота, бімануального дослідження. Застосовують допоміжні методи обстеження: пункцію заднього склепіння піхви, кульдоскопію, лапароскопію. Диференційну діагностику проводять з такими захворюванням, як позаматкова вагітність, гострий апендицит, перекрут ніжки кістоми яєчника та ін.
Лікування. Хворі з апоплексією яєчника при ознаках внутрішньої кровотечі потребують негайного оперативного лікування. Об’єм оперативного втручання визначається станом яєчника: якщо в ділянці яєчника виявляють велику гематому, тканини його зруйновані, то яєчник видаляють (оваріоектомія), якщо ж гематома невелика, видно судину, яка кровоточить, то розрив зашивають або виконують клиноподібну резекцію яєчника. Поверхню рани зашивають вузловими або безперервними кетгутовими швами. Проводять корекцію показників гемодинаміки та гомеостазу в цілому шляхом відновлення об’єму циркулюючої крові, адекватної протишокової, антианемічної терапії, зміцнюючих засобів.
ІШЕМІЯ І НЕКРОЗ ФІБРОМАТОЗНОГО ВУЗЛА
Фіброміоми матки серед пухлин статевих органів трапляються найчастіше і зустрічаються в 15-40 % жінок віком понад 40 років. В основі розвитку фіброміоми матки лежить гормональний дисбаланс у системі гіпоталамус - гіпофіз - кора надниркових залоз - яєчники.
Фіброматозні вузли зароджуються в товщі міометрію, далі ростуть у бік ендометрію (підслизові вузли) або у бік серозного покриву (підсерозні вузли). Нерідко в вузлах фіброміом відбуваються дегенеративні зміни, найчастіше у вигляді фіброзу та гіалінозу.
Некротичні зміни в фіброматозних вузлах спостерігаються в 7-10 % випадків. Некроз вузла пов’язаний із розладом кровообігу (стискання судин, облітерація). Якщо до некротичного вузла гематогенно або лімфогенно потрапляє інфекція, то настає нагноєння пухлини.
Клінічно некроз фіброматозних вузлів проявляється різким болем у животі, підвищенням температури тіла до 390С, ознобом, симптомами пельвіоперитоніту (напруженням передньої черевної стінки в гіпогастрії, позитивним симптомом Щоткіна-Блюмберга, здуттям живота, затримкою газів). У крові - лейкоцитоз, прискорення ШОЕ. Діагноз некрозу фіброматозного вузла встановлюють на основі анамнезу (наявна фіброміома матки), клінічної картини (біль внизу живота, підвищення температури, явища пельвіоперитоніту), вагінального дослідження (наявність фіброматозних вузлів, болючість вузла при пальпації, напруженість його), додаткових методів дослідження (лапароскопія, ультразвукове сканування).
Якщо виявлено некроз фіброматозного вузла, проводять оперативне лікування - ампутацію або екстирпацію матки з видаленням маткових труб (можуть бути джерелом інфекції); у жінок, яким за 40, також видаляють яєчники.
Якщо некроз фіброматозного вузла виник під час вагітності, то вагітну треба госпіталізувати та спостерігати. При розлитому болю та підвищенні тонусу матки необхідно проводити токоліз і трансфузійну терапію.
Оперативне лікування проводять лише тоді, коли симптоми некрозу не зникають. Показаннями до оперативного втручання є висока температура, зростання лейкоцитозу, симптоми загального перитоніту. Залежно від терміну вагітності (28 тижнів і більше), виконують кесарський розтин із наступною екстирпацією матки.
При ранніх термінах вагітності здійснюють ампутацію або екстирпацію матки. Тільки при поверхневому субсерозному розташуванні вузла або наявності субсерозного вузла на ніжці з некрозом без розпаду вузла (внутрішній некроз) можна ризикнути на більш консервативне втручання - видалення цього вузла (енуклеація вузла) із збереженням матки та вагітності. Черевну порожнину в таких випадках обов’язково треба дренувати на три-чотири дні. Зазначимо, що така операція, спрямована на збереження вагітності, часто призводить до підвищення скоротливої діяльності матки, результатом чого є спонтанний аборт або передчасні пологи.
ПЕРЕКРУТ НІЖКИ ПУХЛИНИ ЯЄЧНИКА
Під час росту пухлини яєчника (доброякісної чи злоякісної) зв’язки та прилеглі до яєчника тканини витягуються, утворюючи при цьому так звану ніжку пухлини (кістоми) яєчника. Розрізняють анатомічну та хірургічну ніжки пухлини яєчника. До складу анатомічної ніжки входять власна зв’язка яєчника, підвішуюча зв’язка яєчника та брижа яєчника. В ніжці кістоми проходять кровоносні судини, які живлять пухлину (яєчникова артерія, анастомоз її з матковою артерією), а також лімфатичні судини та нерви (рис. 11.9).

Рис. 11.9. Анатомічна ніжка кісти.
До складу хірургічної ніжки кістоми, крім перелічених утворів, входить перерозтягнута маткова труба. Хірургічну ніжку кістоми доводиться пересікати під час операції при видаленні пухлини (рис 11.10).

Рис. 11.10. Хірургічна ніжка кісти (перекрут).
Патогенез. При достатній рухомості пухлини можливий перекрут ніжки. Це ускладнення з'являється при пухлинах будь-якої гістологічної структури (епітеліальні, строми статевого тяжа, тератоми), не з'єднаних з сусідніми органами. Якщо ніжка кістоми перекручується на 90-1000, кровоносні судини, які проходять в ній, не перетискаються, кровообіг в пухлині не порушується. Клінічно такий перекрут нічим не проявляється. При перекруті ніжки кістоми на 1800 або багаторазовому перекруті перетискаються насамперед вени, внаслідок чого утруднюється чи припиняється відтік крові при ще збереженому її припливі. Це призводить до швидкого набряку капсули пухлини та просякання її кров’ю. Пухлина стає синюшно-багряною, потім темно-фіолетовою, а при розвитку некрозу - темно-сірою, значно збільшується в розмірах.
Перекрут ніжки пухлини яєчника може бути пов’язаний зі зміною положення тіла, фізичним напруженням, посиленою перистальтикою кишкечника, переповненням сечового міхура, переходом пухлини з малого таза в черевну порожнину, із довгою рухомою ніжкою кістоми. Певну роль в цьому процесі відіграють підвищення кров’яного тиску в венах ніжки та самій пухлині, збільшення інтенсивності кровонаповнення, сповільнення кровотоку, венозного застою на фоні зниженого судинного тонусу. Ці ускладнення здебільшого виникають у дівчаток, дівчат та молодих жінок. Частота коливається в межах 6,0-8,5 %.
Клінічна картина. Перекрут ніжки пухлини проявляється ознаками “гострого живота”. Хвора скаржиться на гострий біль в животі, нудоту, інколи блювання. З’являється холодний піт на фоні вираженої блідості шкіри. Часто перекрут ніжки пухлини призводить до розвитку шокового стану. Виявляються перитонеальні ознаки: здутий, болючий при пальпації живіт, різко виражений симптом Щоткіна-Блюмберга в проекції пухлини. Підвищується температура тіла, пульс частий, напружений. При бімануальному дослідженні пальпується напружена, різко болюча пухлина яєчника, збільшена в розмірах за рахунок набряку та крововиливу.
Діагностика перекруту ніжки кістоми грунтується на даних анамнезу, об’єктивного обстеження та додаткових методів обстеження: лапароскопії, ультразвукового дослідження (наявна пухлина, іноді визначається випіт в черевну порожнину).
Диференційну діагностику слід проводити з гострим перитонітом на основі розриву піосальпінксу, некрозу фіброматозного вузла на ніжці, гострого апендициту, гострою кишковою непрохідністю, порушеною трубною вагітністю, апоплексією яєчника, нирковою колікою.
Лікування. При перекруті ніжки пухлини яєчника показане негайне оперативне лікування (протягом перших годин захворювання), поки не настала некротизація пухлини (рис. 11.7; 11.8.). У задавнених випадках оперативне втручання значно складніше внаслідок утворення зрощень із сусідніми органами та кишечником. Об’єм операції при перекруті ніжки пухлини яєчника полягає у видаленні пухлини (кістомектомія). При некрозі пухлини обов’язковим є дренування черевної порожнини. Необхідно проводити протишокову, детоксикаційну, десенсибілізуючу, загальнозміцнюючу терапію. Задавнені випадки потребують профілактичної антибактеріальної терапії. При своєчасному оперативному лікуванні прогноз сприятливий, у запущених випадках при довготривалому перитоніті та інтоксикації зростає ризик післяопераційної смертності.
РОЗРИВ КАПСУЛИ ПУХЛИНИ ЯЄЧНИКА ТА ПІОСАЛЬПІНКСУ
Внутрішньочеревний розрив капсули пухлини яєчника трапляється досить рідко та переважно є наслідком травми живота, необережного дослідження лікаря (пальпація живота, бімануальне дослідження), бурхливого статевого акту, проростання капсули злоякісним процесом та ін.
При розриві капсули пухлини хвора відчуває сильний біль у животі, звичайно гострого характеру, який супроводжується симптомами шоку, інколи - явищами внутрішньочеревної кровотечі (якщо при розриві пошкоджуються судини). Діагноз не завжди легко встановити. Треба використовувати дані анамнезу (травма живота, грубі дослідження), клінічної картини, бімануального обстеження, особливо повторного (якщо при першому дослідженні пальпується кіста яєчника, а при повторному її не стало), додаткових методів дослідження (пункції заднього склепіння, ультразвукового сканування).
Зрідка при розриві капсули пухлини (якщо розривається капсула псевдоміксоми яєчника) розвивається псевдоміксома очеревини. Ця пухлина характеризується великими розмірами, тонкою капсулою, схильною до розриву. Вміст псевдоміксоми яєчника - густа, желеподібна маса. Коли така маса виливається в черевну порожнину, розвивається псевдоміксома очеревини. Настає реактивне запалення очеревини, черевна порожнина заповнюється желеподібними масами у вигляді кіст,що імплантуються в органах черевної порожнини, сальнику, легко спаюються із сусідніми органами та склеюють їх у конгломерати. А це призводить до порушення функцій цих органів, венозного та лімфатичного відтоку, розвитку асциту. З’являється і швидко наростає біль, збільшується в розмірах живіт. Може спостерігатися повільний розвиток псевдоміксоми, коли вона проявляється незначно, перебігає у вигляді хронічного апендициту або пухлини в малому тазі. До оперативного втручання встановити діагноз майже неможливо, навіть під час операції псевдоміксому часто приймають за дисемінований рак яєчника. Тільки гістологічне дослідження допомагає правильно встановити діагноз.
Псевдоміксому яєчника лікують оперативно, тобто уражений яєчник видаляють. Виявивши псевдоміксому яєчника, проводять радикальну операцію, яка полягає у видаленні матки з придатками, сальника, всіх желеподібних мас у черевній порожнині, виконанні апендектомії. У післяопераційний період проводять рентгенотерапію. Прогноз сприятливий.
При розриві стінки ендометріоїдної кісти яєчника розвивається картина "гострого живота": домінують біль різної інтенсивності, розлитий по всьому животі, нудота, блювання, запаморочення, інколи короткочасна непритомність, перитонеальні ознаки. Вміст ендометріоїдної кісти зумовлює подразнення очеревини, відносно швидко розвиваються спайки з сусідніми органами: сечовим міхуром, прямою кишкою, маткою. Навіть мікроперфорації спричиняють розвиток вогнищ ендометріозу в черевній порожнині.
Діагностика розриву кістоми яєчника грунтується на даних анамнезу (наявність пухлини яєчника), клінічних проявах (різкий біль, ознаки "гострого живота").
Лікування. При розриві ендометріоїдної кістоми яєчника необхідно ургентно проводити оперативне лікування. Операція повинна бути консервативною у молодих жінок, обмежуватись, при можливості, резекцією яєчника в межах здорової тканини. У хворих віком понад 40 років, як правило, видаляють матку з придатками.
Піосальпінкс - нагноєння маткової труби - виникає внаслідок неадекватного лікування сальпінгоофориту або після деяких лікувально-діагностичних маніпуляцій при нехтуванні протипоказаннями до їх виконання.
Клінічна картина. Є місцеві та загальні ознаки піосальпінксу. До місцевих симптомів належить біль внизу живота, переважно з боку уражених придатків, який посилюється під час менструації. Інколи спостерігаються менометрорагії. Загальними проявами захворювання є підвищення температури тіла, загальна слабкість, нервово-психічна лабільність, подразливість, анемія, дизуричні прояви.
При вагінальному дослідженні пальпується напружена, малорухома, болюча пухлина. Якщо процес довготривалий, то піогенна капсула товста, внаслідок втягування в процес сальника та петель кишечника пухлина може бути великих розмірів.
Лабораторне дослідження крові не виявляє ознак запалення: нормальна кількість лейкоцитів або невисокий лейкоцитоз за рахунок збільшення кількості нейтрофілів, незначне прискорення ШОЕ. Ультразвукове дослідження виявляє пухлиноподібний утвір у ділянці придатків матки.
При розриві стінки піосальпінксу біль внизу живота значно посилюється, наростають загальна слабість, лихоманка, ознаки подразнення очеревини. Бімануальне дослідження дає змогу виявити утвір тістуватої консистенції без чітких контурів збоку від матки, різко болючий при пальпації, заднє склепіння напружене, болюче. Якщо кількість гною велика, то може виникнути загальний перитоніт. Це характерно для гострого перебігу піогенних пухлин придатків матки. Клініка розлитого перитоніту проявляється посиленням болю по всьому животі з іррадіацією в крижі, підвищенням температури тіла до 390, напруженням м’язів живота та позитивними симптомами Щоткіна-Блюмберга. У загальному аналізі крові спостерігається лейкоцитоз за рахунок паличкоядерних нейтрофілів та моноцитів.
При хронічному розвитку піосальпінксу гній у більшості випадків стає асептичним, тому розрив капсули не дає вираженої клінічної картини гострого перитоніту, здебільшого процес обмежений тазовою очеревиною (пельвіоперитоніт). В такому випадку діагностувати складно.
Діагностика піосальпінксу грунтується на даних анамнезу (гостре або хронічне запалення придатків матки), клінічних проявів (больовий, інтоксикаційний синдроми, перитонеальні ознаки), даних лабораторних та інструментальних методів дослідження.
Лікування. Розрив стінки піосальпінксу підлягає оперативному лікуванню. Виконують серединну лапаротомію, видаляють джерело інфекції. При можливості намагаються зберегти яєчник. Якщо в процес втягнені сальник і петлі кишечника, то необхідно намагатися тупим шляхом від’єднати ці органи від капсули пухлини. Іноді доводиться проводити резекцію ураженої ділянки сальника та кишечника. Необхідно виконати широке дренування черевної порожнини. У жінок старшого віку проводять екстирпацію матки з придатками.
СЕПСИС
Етіологія. За даними літератури сепсис зустрічається у 10,2 - 40,9 % випадків (Кулаков, 1984; Степанківська і співавт., 1989; Сєров, 1989; Сольський і співавт., 1990; Сіренко, 1993).
Мікробні фактори відіграють провідну роль у виникненні сепсису. Серед збудників переважають штами стафілококу, грам негативні бактерії (кишкова паличка, ентеробактерії, клебсієла, протей та інші), анаеробні бактерії (бактероїди, пептококи, пептострептококи).
При бактеріологічного дослідження встановлено, що у 35% хворих збудником є патогенний стафілокок, у 14%- епідермальний стафілокок, у 16% - поєднання стафілококу і грам від’ємних бактерій, у 2,5% - анаеробна флора.
Поширення інфекції можливе гематогенним, лімфогенним шляхом і безпосередньо per continuitatet. Частіше первинно інфікується матка. Інфекція проникає висхідним шляхом із зовнішніх статевих органів і вагіни. У хворих з гнійними захворюваннями додатків матки завжди є септичне вогнище і знижується загальна резистентність організму за рахунок тривалої інтоксикації та порушень обмінних процесів.
Класифікація, патогенез. В останні роки широке розповсюдження отримали терміни “септицемія”, “бактеріємія”, “септичний стан”, “гнійно-септичне захворювання”, в цю термінологію вкладають різний зміст і змішують поняття “інфікованість” і “генералізація інфекції”.
І.В.Давидовський трактує “сепсис” як важкий, неспецифічний інфекційний процес, який перебігає на фоні зміненої реактивності організму. Проте таке трактування не відображає сучасних поглядів і ,на думку М.І.Кузіна, 1982, сепсис правильніше трактувати як самостійне захворювання. Це обумовлено тим, що сепсис, як правило, виникає після тривалого існування часто неадекватно лікованого гнійного вогнища і розвивається в результаті виснаження антиінфекційного імунітету.
П.Н.Напалков, 1982, вважає, що сепсис – це такий варіант гнійного захворювання, коли вплив місцевого вогнища завуальований, імунна реактивність пригнічена, температурна реакція має гектичні коливання або повністю спотворена, є різкий мієлоїдний зсув, із крові і сечі висівається однотипна мікробна флора, є гнійні метастази (в легенях, нирках).
Сепсис характеризується безперервним чи періодичним поступленням в кров мікроорганізмів з гнійного вогнища, мікробною чи тканинною інтоксикацією з розвитком важких поліорганних порушень і часто з утворенням в різних органах та тканинах нових вогнищ гнійного запалення.
Септичний стан викликає в організмі хворої різкі метаболічні порушення, змінює динамічні зв’язки, що регулюють метаболізм в м’язах, печінці, жировій тканині, та формує синдром поліорганної недостатності (Siedel J. H 1983).
Розрізняють 4 патофізіологічних стани цього синдрому:
Стан А - це нормальна стресова відповідь, що спостерігається при компенсованому сепсисі: збільшується частота серцевих скорочень,серцевий індекс - 4 л/хв, підвищення індексу споживання кисню. Ця адаптаційна відповідь симпатичної нервової системи виникає без будь-яких ознак метаболічних порушень і з мінімальною дихальною недостатністю.
Стан B характеризується адаптацією симпатичної нервової системи; гіпердинамічною відповіддю (підвищення ЧСС і серцевого індексу),які не здатні задовільнити потреби периферії. Потреба в кисні знижується, зменшується артеріо-венозна різниця за киснем, виникає метаболічний ацидоз. При метаболічному ацидозі розвивається компенсаторна задишка і респіраторний алкалоз.
Стан С характеризується розвитком дихальної недостатності в організмі жінки, який нездатний регулювати метаболічні порушення, виникає затримка СО 2 і як наслідок виникає респіраторний ацидоз.
Стан Д характеризується розвитком дихальної недостатності та первинної серцевої недостатністю із зниженням серцевого індексу, артеріальною гіпотонією і ацидозом.
КЛАСИФІКАЦІЯ СЕПСИСУ
(Костюченко Б.М., Свєтухін А.П. 1982 р.)
- За наявністю вогнища:
- первинний
- вторинний (при наявності вторинного вогнища)
- За локалізацією первинного вогнища:
- акушерсько-гінекологічний
- хірургічний
- урологічний і інше.
- За збудником:
- Викликаний анаеробною флорою
- грампозитивний:стафілокок,стрептокок
- грамнегативний: колібацилярний, синегнійний, протей
- Викликаний анаеробами:
- клострідіальний
- неклострідіальний
- Викликаний анаеробною флорою
- За фазами розвитку:
- початкова фаза сепсису
- септицемія
- септикопіємія
- За клінічним перебігом:
- Блискавичний, гострий, підгострий, хронічний, септичний шок.
Сепсис частіше виникає внаслідок інфікування матки, інфікування залишків плацентарної тканини, згортків крові, децидуальної оболонки, при гнійних утвореннях додатків матки.
Особливої уваги заслуговує анаеробний сепсис. За даними Ю.В.Цвелева та співавт.,1995, анаеробний сепсис викликається клостридіями, частіше cl. Perfringens. Летальність при клостридіальній формі сепсису є високою.Частою причиною анаеробного сепсису є неспороутворюючі організми (бактероїди, анаеробні стрептококи). При анаеробному сепсисі може зустрічатися як септицемія, так і септикопіємія. Можливий розвиток блискавичної форми, тобто септичного шоку.
Клініка. Сепсис після абортів, при ускладненому перебігу гострого гнійного запального захворювання додатків матки клінічно проявляється септицемією або септикопіємією.
При септицемії в кров'яному руслі і у всьому організмі є бактерії та їх токсини, які на протязі тривалого часу періодично (хвилеподібно) поступають в кровотік або із рани, або із порушених зон мікроциркуляції. Клінічна картина септицемії характеризується: високою температурою тіла (40-41 С), вторинним, лихоманкою, наростанням інтоксикації, що викликає порушення свідомості: спочатку спостерігається загальмованість, потім інтоксикаційний делірій. Підвищення температури тіла супроводжується вираженою тахікардією, тахіпное.
При огляді таких хворих виявляємо ціаноз, гіперемію шкірних покривів, зниження артеріального тиску, підвищення центрального венозного тиску (ЦВТ). На ЕКГ - ознаки перевантаження правих відділів серця. В аналізі крові виявляються зміни: лейкоцитоз і підвищення ШОЕ, зсув лейкоцитарної формули вліво, наростання анемії. Рідко, але можна спостерігати лейкопенію, що свідчить про важкість перебігу захворювання.
У всіх хворих відмічається блідість шкірних покривів із жовтяничним відтінком, ціаноз губ і нігтів, петехіальні висипання на кон’юнктиві очей, шкірі живота і спини, частий і рідкий стілець.
Клінічна картина при септицемії неоднорідна. Поряд із значним стійким підвищенням температури тіла до 40-41 С, частою лихоманкою, спостерігаються клінічні форми з поступовим підвищенням температури, одноразовою лихоманкою, значними перепадами температури тіла на протязі доби.
В загальному для хворих септицемією характерне відносно швидке зниження температури і покращення загального стану на фоні адекватної комплексної терапії.
Виключення складають хворі з блискавичним сепсисом, за типом бактеріально-токсичного шоку.
При нетиповій картині перебігу септицемії картина ускладнюється тим, що цей діагноз повинен бути поставлений у хворої із гнійним ендометритом.
Септикопіємія- це переважно токсична фаза сепсису, в основі якої лежить інтоксикація організму хворої мікробними токсинами, продуктами розпаду мікробних тіл і уражених тканин, що приводить до метастазування в життєво важливі органи.
З первинного інфікованого вогнища (септицемія) інфекція метастазує, розвивається септикопіємія. Клінічна картина септикопіємії: загальний стан хворої важкий, виражені ознаки інтоксикації, температура тіла 40 і вище, адинамія, збудженість, загальмованість, блідість шкірних покривів, ціаноз слизових. Хворі скаржаться на болі в м’язах і суглобах. У хворих є прояви серцевої недостатності ( тахікардії, пульс 120 уд/хв.), тахіпное (20-30 дихальних рухів за 1 хв.). При аускультації серця вислуховується глухість серцевих тонів. Клінічна картина характеризується поліорганною та полісистемною недостатністю. Множинність уражень - найбільш характерний прояв септикопіємії. Проте не у всіх хворих ураження проходить із гнійним метастазуванням (утворенням абсцесів).
Поряд із органними ураженнями у хворих септикопіємією порушується функціональний стан багатьох систем і обмінів, страждає водно-електролітний обмін (гіповолемія, гіпонатріємія), білковий обмін (гіпопротеінемія), порушення вуглеводного обміну (гіпоглікемія), зміни в нирках - ГНН, зміни в печінці – ГПН.
Діагностика: Діагностики сепсису грунтується на трьох ознаках:
- наявність первинного гнійного вогнища;
- лихоманка;
- наявність збудника в крові ( ця ознака відсутня може бути відсутньою).
Ознаки інтоксикації в першу чергу проявляються порушенням в: нервовій системі, дихальній системі, серцево-судинній системі, сечовидільній системі, водно-електролітному балансі.
У хворої при підозрі на сепсис необхідно ретельно оцінити ознаки порушень з боку нервової системи: ейфорію, пригніченість, неадекватну реакцію на оточуючих, розлади сну, розлади апетиту; гемодинамічні показники, так як тенденція до артеріальної гіпотонії є неблагоприємною ознакою в плані виникнення септичного шоку.
Ретельно стежать за погодинним діурезом. Із лабораторних даних найбільш важливі результати гемограми і визначення колоїдо осмотичного стану крові і сечі.
Анаеробний хроніосепсис. При тривало існуючих хронічних вогнищах анаеробної інфекції спостерігається і анаеробний хроніосепсис. Класичнаклінічна тріада Нюренбергу у хворих анаеробним сепсисом: бронзове чи шафранне забарвлення шкірних покривів; темна сеча (колір м’ясних помиїв); темно-коричневий колір плазми крові (лакова кров).
Ю.В.Цвелев і співавт. (1995) при дослідженні анаеробної інфекції виявили такі клінічні та лабораторні дані:
повторні лихоманки, які супроводжуються швидким підйомом температури тіла до 40-41;
парестезії чи сильні м’язеві болі, які посилюються навіть при легкому дотику;
свідомість часто загальмована, спостерігається збудження, марення, галюцинації;
є ознаки серцево-судинної недостатності. У 20 % хворих вислуховується систолічний шум на верхівці, особливо у хворих з септичним ендокардитом, що є поганою прогностичною ознакою;
тахіпноє (більше 30 дихальних рухів за хвилину), зумовлено як легеневою недостатністю, так і гемічною гіпоксією внаслідок масивного гемолізу еритроцитів;
на шкірі через декілька годин після розвитку сепсису можуть з’явитися ціанотичні чи багрово-червоні плями, які чергуються з ділянками мраморної шкіри, а при ДВЗ синдромі-крупні та дрібні крововиливи;
до кінця першої доби шкіра стає землистого кольору, а через декілька годин-жовтянично-бронзовою;
значні зниження білка (до 38-40 г/л), підвищення рівня трансаміназ та загального білірубіну, при цьому дані показники свідчать про печінкову недостатність;
олігурія (менше 20 мл/год) з наступною стійкою анурією і гострою ниркової недостатністю;
гемолітична анемія (гемоглобінемія, гіпербілірубінемія, гемоглобінурія).
Ці зміни виникають частіше при післяпологовому, післяабортному сепсисі.
БАКТЕРІАЛЬНО-ТОКСИЧНИЙ ШОК
Септичний (бактеріально-токсичний) шок це гостра загальна реакція організму на раптове вторгнення в кров мікроорганізмів, їх токсинів і токсичних продуктів протеолізу запальних тканин, що проявляється розвитком важких системних розладів, пов'язаних з порушенням адекватної перфузії тканин.
Вперше цей патологічний процес описали в 1956 р. Studdiford i Douglas. За частотою виникнення бактеріально-токсичний шок займає третє місце після геморагічного і кардіального, а за летальністю - перше. Летальність становить 20 - 80% хворих.
В гінекологічній практиці септичний шок зустрічається після інфікованих і септичних (кримінальних) абортів, після септичного тромбофлебіту вен тазу, у хворих з гнійними утвореннями додатків.
Етіологія. Септичний шок частіше усього ускладнює перебіг гнійно-інфекційних процесів, що викликаються грамнегативною флорою: кишковою паличкою, протеєм, клебсієлою, синєгнійною паличкою. При руйнуванні цих бактерій виділяється ендотоксин, який включає пусковий механізм розвитку септичного шоку. Септичний процес, викликаний грампозитивною флорою (ентерококом, стафілококом, стрептококом), рідше ускладнюється шоком. Причиною розвитку шоку може бути не тільки аеробна бактеріальна флора, але і анаероби, в першу чергу Clostridia perfringens, а також найпростіші і гриби.
Для виникнення шоку, окрім наявності інфекції, необхідно поєднання ще двох факторів: зниження загальної резистентності організму хворої і наявності можливостей для масивного проникнення збудника або його токсинів в кровоток (Литкин И.И. і ін., 1980).
В гінекологічній клініці джерелом інфекції в більшості випадків є матка: післяабортні септичні захворювання. Розвитку шоку сприяють декілька факторів:
- матка є вхідними воротами для інфекції;
- згортки крові і залишки плідного яйця є прекрасним живильним середовищем для мікроорганізмів;
- особливості кровообігу вагітної матки сприяють надходженню бактеріальної флори в кровоносне русло вагітної;
- зміна гормонального гомеостазу;
- гіперліпідемія вагітних;
- алергізація жінок при вагітністю.
Патогенез септичного шоку. Первинне пошкодження, яке пов'язане з виходом збудника та його токсинів з септичного вогнища, веде до формування первинної відповіді організму. Гуморальні фактори бактеріально-токсичного шоку ведуть до агрегації та пошкодження клітинних елементів крові, збільшення мембранної проникливості та змінам інтенсивності клітинного обміну. При цьому вивільняються лізосоми, багаті протеолітичними ферментами, які активізують вазоактивні речовини: кініни, гістамін, серотонін, катехоламіни, ренін. Розлади легеневого газообміну, порушення гомеостазу і збільшення навантаження на міокард є основними пусковими механізмами бактеріально-токсичного шоку.
Первинні розлади при септичному шоці стосуються периферійного кровообігу. Вазоактивні речовини типу кінінів, гістаміну та серотоніну викликають вазоплегію в капілярній системі, що призводить до різкого зниження периферичного опору. Нормалізація і навіть збільшення хвилинного об'єму серця (ХОС) за рахунок тахікардії, а також регіонарне артеріовенозне шунтування (особливо виражене в легенях і судинах черевної зони) не можуть повністю компенсувати порушення капілярного кровообігу. Настає зниження (звичайно, помірне) АТ. Розвивається гіпердинамічна фаза септичного шоку, при якій, незважаючи на те, що периферичний кровообіг є достатнім, капілярна перфузія знижена (табл.2). Бактеріальні токсини пошкоджують клітини, порушується засвоєння кисню і енергетичних речовин. Поряд із виникненням мікроциркуляторних розладів на ранній стадії септичного шоку має місце гіперактивація тромбоцитарної і прокоагулянтної ланок гемостазу з розвитком синдрому дисемінованого внутрішньосудинного згортання (ДВЗ). Отже, в дану фазу шоку порушуються обмінні процеси в тканинах з утворенням недоокислених продуктів. Гіпердинамічна фаза характеризується збільшенням хвилинного об”єму серця (ХОС), зниженням загального периферичного опору (ЗПО) та зменшення артеріовенозної різниці за киснем. При гіподинамічній фазі ХОС зменшений, ЗПО високий, артеріовенозна різниця за киснем збільшена. Гіпердинамічна фаза спостерігалась при шоці викликаному грампозитивною та змішаною інфекцією, а гіподинамічна - при грамнегативній інфекції(табл.1).
Ю.Шутеу, А.Кафрице, 1981 проводять диференційний діагноз шоку грампозитивної та грамнегативної етіології.
Таблиця 1. Диференційна діагностика шоку грам позитивної та грам негативної етіології (Ю.Шутеу, А.Кафрице, 1981)
| Бактеріальний шок, викликаний грампозитивним збудником | Бактеріальний шок, викликаний грамнегативним збудником |
| АТ помірно знижений | АТ різко знижений |
| Температура шкіри в нормі | Шкіра холодна |
| Відсутність блювоти та проносу | Наявність блювоти та проносу |
| Незначні нейротоксичні розлади | Важкі нейротоксичні розлади |
| Розширення судин в зоні мікроциркуляції | Вазоконстрікція в ділянці мікроциркуляції |
| Дебіт серця нормальний | Дебіт серця знижений |
| Помірний ацидоз чи його відсутність | Виражений ацидоз |
| Летальність 30-40 % | Летальність 60-90 % |
Вважається, що гіпердинамічна фаза є ранньою, а гіподинамічна –пізньою стадією бактеріально-токсичного шоку ( Б.Л.Гуртовой, А.Д.Макацарія, 1977).
Триваюча пошкоджуюча дія бактерійних токсинів призводить до поглиблення циркуляторних розладів. Вибірковий спазм венул в комбінації з прогресуванням ДВЗ-синдрому сприяє секвестрації крові в системі мікроциркуляції. Підвищення проникливості стінок судин веде до просякання рідкої частини крові, а після цього і форменних елементів в інтерстиціальний простір. Ці патофізіологічні зміни сприяють значному зменшенню ОЦК - наступає гіповолемія. Приток крові до серця значно зменшується. Хвилинний об”єм серця, незважаючи на різку тахікардію, не може компенсувати наростаючі порушення периферичної гемодинаміки. Бактеріально-токсичний шок-це дисволемічний шок, тому що при збереженому загальному об’ємі рідини, зменшується ефективно циркулюючий об’єм крові (ЕЦОК) через затримку рідини на периферії ( Ю.Шубеу та співавт., 1981). ЕЦОК зменшується за рахунок зменшення венозного кровотоку до серця та хвилинного об’єму.
Розрізняють три основних етапи патогенезу септичного колапсу: 1) зменшення венозного притоку, особливо портального; 2) тахікардія в поєднанні з гіпертермією з частим настанням колапсу на вершині піку температури, за рахунок низького серцевого викиду через тахікардію; 3) гіповолемію, яка пов”язана з попередніми причинами чи неефективною реанімацією, що посилює попередні фактори.
Пояснити різноманітність гемодинамічних порушень при бактеріально-токсичному шоці можна враховуючи наступні дані: 1) складність патогенезу з великою кількістю патогенетичних факторів - порушення мікроциркуляції, ДВЗ, ураження міокарду, дія бактеріальних токсинів, гіповолемія та інш.; 2) надзвичайну мозаїчність змін мікроциркуляції - поєднання спазму та дилятації артеріол, капілярів, венул та артеріовенозних шунтів; 3) обстеження хворих в різні терміни від моменту захворювання; 4) неоднорідність груп, які обстежувались; 5) обстеження хворих на фоні лікування (Я.П.Сольський і співавт., 1990).
Бактеріально-токсичний шок ставить надмірні вимоги до міокарду, який в несприятливих умовах існування не може забезпечити адекватне постачання організму киснем і енергетичними субстратами. До порушення серцевої діяльності призводить комплекс причин: погіршення коронарного кровотоку, негативна дія токсинів мікроорганізмів і тканинних метаболітів, зниження реакції міокарду на адренергічну стимуляцію і набряк м'язевих елементів. Настає стійке зниження АТ. Розвивається гіподинамічна фаза шоку. В цю фазу шоку порушення тканевої перфузії, що прогресує, призводить до подальшого поглиблення тканинного ацидозу на фоні різкої гіпоксії. Обмін речовин відбувається за анаеробним шляхом.
За наявності гнійної інфекції в організмі легені працюють з високим навантаженням і більшим напруженням. Шок ускладнюється гострою дихальною недостатністю (ГДН), при якій настає глибоке порушення кисневого забезпечення організму. Знижується перфузія ниркової тканини, відбувається перерозподіл ниркового кровотоку з зменшенням кровопостачання коркового шару- формується "шокова нирка", розвивається гостра ниркова недостатність. Олігоанурія призводить до патологічних змін водно-електролітного балансу, порушується виведення продуктів метаболізму.
Підвищення вмісту в крові органоспецифічних ферментів, гіпербілірубінемія свідчить про пошкодження. Порушення мікроциркуляції, що супроводжуються утворенням тромбоцитарно-фібринових тромбів, поєднується з ділянками крововиливів, спостерігаються в деяких відділах мозку, зокрема в аденогіпофізі і діенцефальній ділянці.
Для шоку характерні екстравазати і некротичні ураження шкіри, пов'язані з порушенням мікроциркуляції та з безпосереднім пораженням клітинних елементів токсинами.
Таким чином, в патогенезі септичного шоку можна виділити наступні основні моменти. У відповідь на надходження в кров'яне русло токсинів відбувається викид вазоактивних речовин, збільшується мембранна проникність, розвивається синдром ДВЗ. Все це призводить до порушення периферійної гемодинаміки, розладу легеневого газообміну, збільшення навантаження на міокард. Прогресування патофізіологічних змін, в свою чергу, призводить до невідповідності енергетичних потреб органів і тканин можливостям доставки кисню і енергетичних субстратів. Розвиваються глибокі метаболічні порушення, які сприяють пошкодженню життєвоважливих органів. Формуються "шокова" легеня, ''шокова’’ нирка і ’’шокова'' печінка, виникає серцева недостатність і як останній етап гомеостатичного виснаження може настати загибель організму (Литкин М.И. и др., 1980).
Клініка. Клінічна картина бактеріально-токсичного шоку досить типова. Вираженість окремих симптомів залежить від фази шоку, тривалості його перебігу, ступеня вираженості пошкодження різних органів і захворювання, на фоні якого развивався шок.
Бактеріально-токсичний шок настає гостро, частіше усього після операцій або будь-яких маніпуляцій у вогнищі інфекції, що створюють умови для "прориву" мікроорганізмів або їх токсинів в кров'яне русло.
Клінічним симптомом прориву інфекційного агенту з вогнища та поступлення його в кровообіг є, насамперед виражена прогресуюча лихоманка гектичного чи неправильного типу з підвищенням температури тіла до 40-41 С. Одночасно з”являються помірно виражена задишка та порушення кровообігу, які проявляються тахікардією до 110-120 уд/хв. При прогресуванні захворювання температура тіла тіла максимально підвищується з лихоманкою. Одночасно відбуваються зміни з боку нервової системи: неадекватність поведінки, збудження, психоз. Зміна поведінки хворої є нерідко одним із основних симптомів шоку.
При огляді хворих шкіра гіперемована, суха, дихання поверхневе часте, тахікардія до 120 уд/хв.
Основною ознакою шоку є падіння АТ без крововтрати, що передує, або не відповідає їй. При гіпердинамічній, або "теплій" фазі шоку систолічний АТ знижується до 80-90 мм рт. ст. (табл. 2). На цих цифрах АТ тримається недовго: від 15-30 хв до 1-2 год. Тому гіпердинамічна фаза шоку інколи пропускається лікарями. Гіподинамічна, або "холодна" фаза септичного шоку характеризується більш різким і тривалим падінням АТ (інколи нижче критичних цифр). У деяких хворих можуть наставати короткочасні ремісії. Такий стан триває від декількох годин до декількох діб.
Таблиця 2. КЛІНІЧНІ ОЗНАКИ ГІПЕРДИНАМІЧНОЇ ТА ГІПОДИНАМІЧНОЇ ФАЗ ІНФЕКЦІЙНО-ТОКСИЧНОГО ШОКУ
(Г.Р.Гельфанд,1986)
| Клінічна ознака | Гіпердинамія | Гіподинамія |
| Зовнішній вигляд хворого | Шкіра гіперемована, волога чи суха | Шкіра бліда з мармуровим малюнком, іноді землиста; акроцианоз |
| Температура тіла | Висока, інколи лихоманка | Помірна гіпертермія, гіпотермія у 5 % хворих |
| Психічний стан | Неадекватність, ейфорія, дезорієнтація, психомоторне збудження | Збудження, потьмарення свідомості, сопор |
| Дихання | Тахіпное, частота дихання до 30 в 1 хв | Тахіпное, частота дихання більше 30 в 1 хв |
| Частота серцевих скорочень | Тахікардія, частота серцевих скорочень (110± 10) за 1 хв | Виражена тахікардія, частота серцевих скорочень (125± 10) за 1 хв |
| Артеріальний тиск | Нормальний чи підвищений з низьким пульсовим тиском, інколи помірна гіпотензія | Гіпотензія |
| Сечовиділення | Олігурія (20-30 мл\год) | Олігурія (менше 30 мл\год) |
Поряд з падінням АТ розвивається виражена тахікардія до 120-140 уд/хв. Шоковий індекс звичайно перевищує 1,5 при нормі 0,5. Цей факт свідчить про досить швидке зниження ОЦК.
Для клінічної картини шоку характерна рання поява вираженої задишки (від 30 до 60 дихальних рухів за хв). Тахіпное свідчить не тільки про нарастаючий тканинний ацидоз, але і про формування "шокової" легені.
З’являються характерні зміни з боку шлунково-кишкового тракту: болі в епігастральній ділянці, які посилюються, поява часто рідкого стільця.
Гіперемія і сухість шкірних покривів швидко змінюються блідістю, похолоданням, липким холодним потом. Часто виникають висипання Herpes labialis. У випадку приєднання печінкової недостатності шкіра набуває жовтяничного відтінку. Акроціаноз, петехіальні висипання на обличчі, грудях, животі, на згинальних поверхнях кінцівок з'являються в більш пізні терміни.
При дослідженні крові відмічається наростання лейкоцитозу, компенсований метаболічний ацидоз на фоні гіпокапнії та підвищення рівня органічних кислот, низький вміст натрію в плазмі та тенденція до гіперкаліємії.
На клінічну картину шоку часто накладаються симптоми гострої ниркової недостатності, гострої дихальної недостатності, а також кровотечі внаслідок прогресування синдрома ДВЗ крові.
Гостра ниркова недостатність (ГНН). Найбільш небезпечним ускладненням шоку є ГНН. Функція нирок при шоці порушується рано і виявляється в виді олігоурії: погодинний діурез складає менше 30 мл. В початковій стадії ГНН страждає фільтраційна спроможність клубочків через спазм судин коркового шару і загальної гіпотонії. Подальше прогресування патологічного процесу (спазм судин, стаз з розвитком сладж-синдрому, мікротромбоз) призводить до поглиблення місцевої гіпоксії і пошкодження нефрону. Ступенем ураження нефрону пояснюється розвиток олігоурії або анурії. Найважча ГНН розвивається при некрозі коркового шару нирок. Важкий перебіг ГНН і летальні наслідки , на думку І.Р.Зака, 1986, пов”язані з тотальним, субтотальним чи сегментарним кортикальним некрозом, який є ознакою Санареллі-Швартцмана.
Клінічно виражені симптоми ГНН виявляються у половини хворих з септичним шоком. Окрім олігоанурії, ГНН проявляється швидко нарастаючою азотемією, порушенням електролітного балансу (в першу чергу, ознаками гіперкаліємії) і змінами КОС крові. Хворі мляві, сонливі, загальмовані. З'являються болі в ділянці серця, порушення ритму серця, інколи брадикардія, наростає задуха, можуть приєднуватися клонічні судоми. Найбільша небезпека в цей період - зупинка серця. При сприятливому перебігу наступає наступна стадія - відновлення діурезу, при якому мають місце порушення електролітного балансу з гіпокаліємією.
Гостра дихальна недостатність (ГДН). Порушення дихальної функції легень супроводжують перебіг шоку у всіх хворих. Однак інтерстиціальний набряк легень не має вираженої клініки. Існуюча задуха звичайно розцінюється як компенсаторна реакція на метаболічний ацидоз. Фізичними методами діагностується тільки виражений процес у вигляді інтраальвеолярного набряку, що безпосередньо загрожує життю. Допомагає діагностиці ГДН рентгенологічне дослідження легень.
Особливо небезпечним ускладненням шоку може бути маткова кровотеча як прояв синдрома ДВЗ в фазі коагулопатії споживання.
Окрім описаних "теплої" і "холодної" фаз шоку, R.Knuppel і ін. (1984) і D.Cavanagh і ін. (1985) виділяють третю фазу: "незворотній", або "вторинний" шок. Третя фаза виявляється анурією, дихальною і серцевою недостатністю і комою внаслідок тривалої гіпоксії клітин і анаеробного гліколізу, вираженого метаболічного ацидозу і підвищенням рівня лактату в крові.
Бактеріально-токсичний шок у хворих з гнійними утвореннями додатків матки обов’язково протікає з гострими запальними змінами уражених додатків та гострим пельвіоперитонітом. В цьому одна з основних відмінностей прояву шоку у даних жінок від перебігу у жінок, в яких розвивається маткова форма ( М.І.Литкин і співавт., 1980), яка пов’язана з позалікарняними абортами. У даних хворих, поряд з такими загальними проявами шоку, як виражена гіпертермія, лихоманка, задишка, зниження артеріального тиску, болі в животі, частий рідкий стілець є інші симптоми. На протязі перших 12 годин з’являються герпетиформні чи геморагічні висипання на губах, щоках та інших ділянках шкіри. Вони швидко переходять в некротичні, створюючи найбільш характерну для цієї форми картину у вигляді крил метелика.При бактеріально-токсичному шоці у хворих з позалікарняними абортами частота розвитку ГНН складає більше 50 % (Л.С.Слепих і спіавт., 1981) і перебіг його більш важкий, ніж у хворих з гнійними ураженнями додатків матки.
Бактеріально-токсичний шок смертельно небезпечний для хворої, тому важлива своєчасна, тобто рання, його діагностика. Фактор часу при даному виді шоку відіграє вирішальну роль, бо незворотні зміни в організмі настають надзвичайно рано: в межах 6-8 год, рідше 10-12 год.
Діагностика.
Діагноз бактеріально-токсичного шоку встановлюється на основі таких клінічних проявів:
- наявність септичного вогнища в організмі;
- гіпертермія (більше 38 С), яка змінюється гіпотермією (менше 35 );
- падіння артеріального тиску не відповідає ступеню крововтрати, систолічний артеріальний тиск не вище 90 мм рт ст;
- олігоурія- хвилинний діурез менше 30 мл/хв, анурія;
- наявність дихальної недостатності (тахіпное);
- ознаки декомпенсованого кровообігу;
- болі в животі, грудній клітині, кінцівках, поясниці, головний біль;
- виражені порушення електролітного балансу(декомпенсований метаболічний ацидоз);
- петехіальні висипання, некроз ділянок шкіри;
- нейротоксикоз (токсична енцефалопатія, набряк мозку, інтоксикаційний психоз);
- лейкоцитоз чи лейкопенія;
- тромбоцитопенія.
Оцінка даних клінічного спостереження і лабораторних досліджень дозволяє своєчасно встановити діагноз шоку і виявити ступінь порушення функцій хворого організму.
Лікування. Інтенсивна терапія септичного шоку здійснюється акушером-гінекологом спільно з реаніматологом, а при необхідності - з нефрологом, урологом і гематологом-коагулологом.
Проведення лікувальних заходів вимагає постійного (краще моніторного) спостереження. Необхідно здійснювати обов'язковий контроль за температурою тіла, станом шкірних покривів, частотою дихання і пульсу, показниками АТ і ЦВТ, гематокриту, ЕКГ, погодинним діурезом, кислотно-основним і електролітним складом плазми, протеїнограмою, вмістом азотистих шлаків і білірубіну крові, коагулограмою. Бажано визначати ОЦК і величину серцевого викиду. Лікування проводиться комплексно. Воно направлене на боротьбу з шоком і інфекцією, на профілактику і терапію ускладнень септичного шоку: ГНН, ГДН і кровотеч внаслідок порушень згортальної системи крові.
Заходи по боротьбі з шоком повинні бути зосереджені на відновленні тканинного кровообігу, на корекції метаболічних порушень і на підтриманні адекватного газообміну.
Два перших завдання вирішуються шляхом проведення інфузійної терапії, яку необхідно почати якомога раніше і здійснювати тривалий час. Проводиться катереризація 3 магістральних вен.
Проводять інфузію похідних декстрану (по 400-800 мл реополіглюкіну). Вони відновлюють і покращують реологічні властивості крові завдяки цьому сприяють зменшенню в'язкості, усуненню стазу та агрегації форменних елементів, покращенню мікроциркуляції, підвищують ОЦК. Особливо важливою властивістю даних інфузійних середовищ є здатність адсорбувати токсини і виводити їх з організму.
Розчин желатину, особливо декальцинований желатиноль, можна вводити до 1000 мл. Цей препарат добре переноситься хворими; може змішуватися з донорською кров'ю в будь-яких пропорціях, не викликає агрегації еритроцитів, швидко виводиться нирками, сприяючи детоксикації.
Для підвищення колоїдно-осмотичного тиску з метою залучення рідини з інтерстиціального простору в кров'яне русло застосовують білкові препарати: 400 мл 5-10% розчину альбуміну, 500 мл протеїну. Ці препарати ліквідують гіпопротеїнемію, завжди наявну при септичному шоці, а також виявляють виражену детоксикаційну дію. Переливають суху і нативну плазму, що добре підтримує осмотичний тиск і завдяки цьому сприяє відновленню ОЦК. З метою відновлення ОЦК вводиться до 500 мл рефортану, 500 мл стабізолу.
Гемотрансфузії не є основним засобом для ліквідації гіповолемії при бактеріально-токсичному шоці. Гемотрансфузія проводиться, якщо показник гематокриту нижче 30% (0,3 л/л). Переливають свіжі відмиті еритроцити чи еритроцитарну масу до 3-го дня зберігання (300-500 мл). Гемотрансфузії здійснюються паралельно з вливанням реологічно активних плазмозамінників або кристалоїдних розчинів в режимі гемодилюції. При поєднанні шоку з кровотечею об'єм гемотрансфузії повинен відповідати ступеню крововтрати.
В склад інфузійной терапії включають 10% або 20% розчин глюкози в кількості 300-500 мл. Перевага концентрованих розчинів глюкози полягає в тому, що вони не тільки поповнюють енергетичні затрати організму,але й мають осмодіуретичну дію, що є важливим при лікуванні хворих бактеріально-токсичним шоком.
Швидкість інфузії та кількість рідини, що вливається, залежать від реакції хворої на терапію. Пульс, артеріальний тиск, центральний венозний тиск, хвилинний діурез слід оцінювати після інфузії кожних 500 мл рідини. Загальна кількість введеної рідини на першу добу, як правило, складає 3000-4500 мл, але може досягати 6000 мл. При проведенні інфузії слід враховувати діурез, втрату рідини через шкіру і легені , з блювотними масами .
В.Н.Серов, С.А.Маркин (1986) з успіхом використали малі дози дофаміну (допаміну). Цей середник підвищує АТ, посилює серцеві скорочення і збільшує серцевий викид. Крім того, малі дози дофаміну (1-5 мкг/кг/хв) зменшують опір ниркових судин, збільшують нирковий кровообіг і клубочкову фільтрацію, що підвищує ефективність дії препарату при септичному шоці. 5 мл 0,5% розчину дофаміну розводять в 125 мл ізотонічного розчину натрію хлориду або 5% розчину глюкози і вводять внутрішньовенно дуже поволі по 2-10 крап. за хв.Використовується також допутамін 2-3 мг/кг/хв.
При вазомоторному коллапсі, що продовжується, після відновлення об’єму ОЦК можна скористатися (обережно!) повільним крапельним введенням ангіотензинаміду. Звичайно інфузію препарату починають з розрахунку 3-5 мкг/хв, при необхідності збільшуючи дозу до 10-20 мкг/хв. При досягненні необхідного ефекту (підвищення АТ до 90-100 мм рт. ст.) дозу можна зменшити. Для приготування концентрації 1 мкг/мл 1 мг (1 флакон) препарату розчиняють в 1000 мг ізотонічного розчину натрію хлориду або 5% розчину глюкози, а для одержання концентрації 2 мкг/мл - в 500 мл розчинника.
Глюкокортикостероїди, збільшуючи серцевий викид, покращують діяльність серця; мають судинорозширюючу дію, покращують мікроциркуляцію: знижуючи надходження тканинного тромбопластину і попереджуючи наростання агрегації тромбоцитів, зменшують вираженість синдрому ДВЗ. Крім того, ці препарати послаблюють дію ендотоксину, стимулюють діяльність ферментів, що беруть участь в окисних процесах, підвищують толерантность клітин в умовах гіпоксії, сприяють стабілізації мембран, попереджують розвиток "шокової" легені, мають антигістамінний ефект.
Протишокова дія глюкокортикостероїдів проявляється при введенні середніх і високих доз препаратів. Одномоментно вводять 250-500 мг гідрокортизону, або 60-120 мг преднізолону, або 8-16 мг дексаметазону. Через 2-3 год. введення препарату повторюють. Критерієм ефективності включення глюкокортикостероїдов в комплекс лікувальних заходів є загальний стан хворої, забарвлення і температура шкірних покровів, АТ і погодинний діурез. За добу вводиться до 1000-3000 мг гідрокортизону або еквівалентні кількості преднізолону та дексаметазону. Такі дози застосовуються протягом 1-2 днів. Відсутність ефекту на значні дози глюкокортикостероїдов (1000 мг гідрокортизону або відповідні кількості преднізолону чи дексаметазону) свідчить про глибокі незворотні зміни в життєвоважливих органах і є поганою прогностичною ознакою. В таких випадках немає необхідності в продовженні гормональної терапії.
Основними клінічними критеріями, що свідчать про ліквідацію гіповолемії і відновлення ОЦК, є : звичайне забарвлення шкірних покривів, ЦВТ -50-100 мм вод. ст., достатній діурез (більше 30 мл/год. без застосування діуретиків, 60-100 мл/год. - при форсованому діурезі). Артеріальний тиск при бактеріально-токсичному шоці може тривалий час залишатися на відносно низьких цифрах - 90 мм рт. ст. Немає необхідності форсувати його підвищення, якщо є ознаки покращення мікроциркуляції (колір шкірних покровів, достатній погодинний діурез).
На фоні відновнення ОЦК і покращення реологічних властивостей крові для корекції гемодинаміки і відновлення тканинного кровообігу застосовують серцеві та вазоактивні засоби. Серцеві глікозиди вводять внутрішньовенно разом з 20 мл 40% розчину глюкози в звичайних дозах: 0,5-1 мл 0,05% розчину строфантину або 0,5-1 мл 0,06% розчину корглікону, або 1-2 мл 0,02% розчину ізоланіду, 1-2 мл 0,025% розчину дігоксину. Доцільно після ліквідації гіповолемії використати 0,5% розчин курантилу. Курантил розширює коронарні судини, підвищує толерантность міокарду до гіпоксії і, крім того, гальмує агрегацію тромбоцитів.
В терапії бактеріально-септичного шоку з метою розширення периферичних судин застосовують вазодилятатори: еуфілін, папаверин, но-шпа або компламін. Ці препарати призначаються після відновлення ОЦК під контролем АТ. Препарати вводять в звичайних дозах: 5-10 мл 2,4% розчину еуфіліну, 2 мл 2% розчину папаверину, 2-4 мл 2% розчину но-шпи. Компламін активно розширює артеріоли і венули. Одночасно з зменшенням периферичного опору збільшується хвилинний об'єм серця. 2мл 15% розчину компламіну вводиться внутрішньовенно повільно.
Враховуючи зміни в системі гістамін-гістаміназа при бактеріально-токсичному шоці, необхідно вводити антигістаміні препарати: 1-2 мл 1% розчину димедролу, 1-2 мл 2,5% розчину дипразину (піпольфену) або 1-2 мл 2% розчину супрастину або 2 мл тавегілу.
Корекція кислотноосновного і електролітного гомеостазу є актуальною при лікуванні бактеріально-токсичного шоку.
При шоці досить швидко розвивається метаболічний ацидоз, що на перших порах може компенсуватися дихальним алкалозом. Для корекції ацидозу в склад інфузійной терапії включають 500 мл лактасолу, 500 мл Рінгер-Лактата або 150-200 мл 4-5% розчину бікарбонату натрію.
Для покращення окислювально-відновних процесів застосовується розчин глюкози з вітамінами: 1-2 мл 6% розчину вітаміну B1, 1-2 мл 5% розчину вітаміну В6, 400-500 мкг вітаміну B12, 100-200 мг кокарбоксилази, 5-10 мл 5% розчину аскорбінової кислоти. Для покращення функції печінки, окрім вітамінів і коферментів, бажано використовувати холіну хлорид в кількості 200 мл у вигляді 1% розчину, 10-20 мл есенціалє (ліпостабіл 1-2 мл 1 раз в день), 2 мл сирепару або інші гепатотропні засоби.
Бактеріально-токсичний шок швидко призводить до електролітного дисбалансу. Вже на ранніх етапах його розвитку є зниження вмісту іонів К, Na, Са, Мg в плазмі. В першу добу лікування необхідно коригувати нестачу цих іонів шляхом крапельної внутрішньовенної інфузії. З цією метою можна використати панангін в кількості 10-20 мг або 4% розчин калію хлориду в кількості 50 мл з 400-500 мл ізотонічного розчину глюкози. Не слід забувати про введення 10 мл 10% розчину кальцію хлориду або 100 мл 1% розчину того ж препарату. М.І.Литкин і ін. (1980) повідомляють про успішне застосування енергетичного полііонного розчину такого складу: на 1000 мл 25% розчину глюкози додають 3 г калію хлориду, 0,8 г кальцію хлориду і 6 г магнію хлориду. Обов'язкове введення адекватних доз інсуліну. Необхідність в подальшому введенні електролітних розчинів повинна підтверджуватися лабораторними даними; особливу обережність слід виявляти за наявності ознак ГНН.
Поряд з відновленням гемодинаміки і корекції метаболічних порушень велике значення має забезпечення адекватної оксигенації. Введення кисню необхідно починати з перших хвилин лікування, використати для цього всі наявні засоби аж до штучної вентиляції легенів (ШВЛ). Абсолютним показом є падіння РО2 нижче 60-70 мм рт. ст. при вдиханні 100% кисню через маску. Кисень подається через носовий катетер, маску; при необхідності проводиться інтубація трахеї та штучна вентиляція легень. З метою ліквідації чи зменшення всіх форм кисневої недостатності можна проводити сеанси гіпербаричної оксигенації ( табл.4). Найбільш оптимальним режимом ГБО є тиск 1,5- 2 атм тривалість сеансу 45-60 с, Курс лікування –6-7 сеансів, які проводяться через день. ГБО нормалізує показники зовнішнього дихання та газообміну, покращує коронарний кровобіг, збільшує печінковий кровообіг, нормалізує периферичну гемодинамік, має антибактеріальну дію.
Використання інгібіторів протеаз.Згідно літературних даних важлива роль в патогенезі бактеріально-токсичного шоку належить підшлунковій залозі. Один з шляхів втягнення підшлункової залози в патогенез шоку-це катехоламінова інтоксикація. Призначається контрикал по 10000 ОД на добу внутрішньовенно крапельно.
Поряд з протишоковими заходами невід'ємну частину інтенсивної терапії шоку складає боротьба з інфекцією. Антибактеріальна терапія при септичному шоці є екстреною, починається з введення антибіотиків широкого спектру дії (табл.3). Лікування починається з тієнаму 1,0 4 рази на добу внутрішньовенно або призначається поєднання двох антибіотиків: цефалоспорини і аміноглікозиди (кефзол по 1,0 4 рази на добу внутрішньовенно та гентаміцин по 80 мг 3 рази на добу внутрішньом”язево та препарати метронідазолу-метрогіл 100 мл 4-6 раз на добу внутрішньовенно). Частіше призначаються цефалоспорини широкого спектру дії -цефуроксим (по 0,75 г 3 рази на добу) , мефоксин (1-2 г 3 рази на добу), клафоран (по 1 г 3 рази на добу). При цьому 2 дози вводять внутрішньовено, а одну –внутрішньом’язево. Цефтріаксон призначають по 2 г 2 рази на добу внутрішньовенно. Цефамезин призначають по 1 г кожні 6-8 год. внутрішньом'язово або внутрішньовенно; максимальна добова доза -4 г.
Призначають препарати антианеробної дії-метроджил по 500 мг 2 рази на добу.
Застосовують напівсинтетичні пеніциліни. Метациліну натрієву сіль вводять по 1-2 г кожні 4 год внутрішньом'язово або внутрішньовенно. Для внутрішньовенного крапельного вливання кожний грам препарату розводять в 100 мл ізотонічного розчину натрію хлорида. Максимальна добова доза - 12 г. Оксациліну і диклоксациліну натрієва сіль застосовуються по 1 г кожні 4 год. внутрішньом'язово або внутрішньовенно; для крапельного внутрішньовенного введення препарати розводять в 100 мл ізотонічного розчину натрію хлориду; максимальна добова доза - 6 г. Ампіциліну натрієва сіль (пентрексил) вживається по 1,5-2 г кожні 4 год. внутрішньом'язово або внутрішньовенно з 20 мл ізотонічного розчину натрію хлориду: максимальна добова доза - 12 г. Карбеніциліну динатрієву сіль (піопен) вводять по 2 г через 4 год. внутрішньом'язово або внутрішньовенно в 40 мл ізотонічного розчину натрію хлориду; добова доза антибіотика -12 г.
Таблиця 3. ХАРАКТЕРИСТИКА СУЧАСНИХ АНТИБАКТЕРІАЛЬНИХ ПРЕПАРАТІВ.
| Назва препарату | Цефуроксим (зінацеф, кетацеф) | Цефокситин (мефоксим) | Цефотетан | Цефотаксим (клафоран) | Цефтріаксон (лонгацеф, роцефин) | Цефобід (цефаперазон) | Гентаміцин | Доксациклін(вібраміцин) | Тобраміцин | Тетрациклін | Офлоксацин (таривид) | Ципрофлоксацин(ципрофлокс, ципринол, ципробай, ципроквінтор) | Еритроміцин | Кліндаміцин (Далацин С) | Метронідазол (кліон, флагін, трихопол) |
| Група | цефалоспорини 11 генерації | цефалоспорини 11 генерації | цефалоспорини 11 генерації | цефалоспорини 111 генерації | цефалоспорини 111 генерації | цефалоспорини 111 генерації | аміноглікозид 11 генерації | гр.тетрациклінів | аміноглікозид 111 генерації | З групи тетрациклін | Гр.фторхінолонів | Гр.фторхінолонів | Гр. макролідів (азолідів) | Група резерву | |
| бактерицидна | бактерицидна | бактерицидна | бактерицидна | бактерицидна | бактерицидна | бактерицидна | бактерицидна | бактерицидна | бактерицидна | бактерицидна | бактерицидна | бактерицидна | бактерицидна | бактерицидна | бактерицидна |
| Спектр антимікробної дії | Г+ і деякі Г- (ешеріхії, клебсіели,протей, ентеробактерії).Не діє на стафілококи та беталактамазні штами | Г+ і деякі Г- (ешеріхії, клебсіели,протей, ентеробактерії). Не діє на деякі Г-бактерії та анаероби | Г+ і деякі Г- (ешеріхії, клебсіели, протей, ентеробактерії).Не діє на деякі Г-бактерії та анаероби | Г+ і всі Г-бета-лактамазні штами, які стійкі до інших препаратів . Менш активний до стрепто-, пневмо-, стафіло-, гоно-, менінгококів, бактероїдів | Г+ і Г- беталактамазні штами, які стійкі до інших препаратів. Не діє на хламідії. | Г+ і Г- беталактамазні штами, анаероби, синьогнійну паличку. Не діє на хламідії. | Г-, синьогнійну паличку. Слабка дія на Г+, не діє на анаероби. | Більшість аеробних Г+ і Г- бактерій, клостридії. Не діє на анаероби. | Більшість Г- , синьогнійну паличку.Слабка дія на Г+, не діє на анаероби. | Більшість аеробних Г+ і Г- бактерій, хламідії, клостри-дії, мікоплазми. Не діє на анаероби. | Діє на всі Г-, деякі Г+ (стафілококи), а також мікоплазми та хламідії. Не діє на анаероби , крім B.Urealiticus. | Діє на всі Г-, деякі Г+ (стафілококи), а також мікоплазми та хламідії. Не діє на анаероби , крім B.Urealiticus. | Більшість Г+ і Г- бактерій, хламідії, мікоплазми, збудники токсоплазмозу.Не діє на анаероби | Г+ та деякі анаероби. Не діє на Г-, гриби, віруси. | Облігатні споро- та неспороутворюючі анаероби, найпростіші (трихомонади, лямблії). Аеробні бактерії |
| Шляхи введення | в\в,в\м, перорально | в\в,в\м, перорально | в\в,в\м, | в\в,в\м, | в\в,в\м, | в\в,в\м, | в\м | в\в перорально | в\в | перорально | перорально | в\в перорально | в\в перорально | В\в, в\м | В/в |
| Дози | 0,75-1.5 г 3 рази в\в,в\м | 1-2 г 3 рази в\в,в\м | 1-2 г 2 рази на добу | 1-2 г 3-4 рази на добу | 2 г 1 раз на добу (в важких випадках по 2 г 2 рази на добу | 1 г рази чи2 г 2 рази (в важких-до 8 г\доб) | 0,08г кожні 8 год | 1-0,2 г в наступні 0,1 г однократно | 0,21-0,35 г кожні 8 год | По 0,2-0,25 г 3-4 рази на добу | По 0,2-0,3-0,4 г 2 рази на добу | По 0,25-0,5-0,75 г 2 рази на добу в\в чи перорально по 0,5 г 2 рази на добу | 0,2 г 2-3 рази на добу. Перорально по 0,25 г 4 рази на доб | По 0,3-0,45 кожні 6 год | 0,5 г (100 мл) 3 рази на добу, перорально 0,5 г 3 рази на добу |
Широким спектром антимікробної дії володіють антибіотики групи аміноглікозидів. Максимальна добова доза канаміцину сульфату - 2 г, вводять його по 0,5 г кожні 6 годин. Максимальна добова доза гентаміцину сульфату - 240 мг, препарат вводять по 80 мг кожні 8 год. В таких же дозах застосовують тобраміцину сульфат. Максимальна доза амікацину (напівсинтетичного канаміцину) - 1,5 г; застосовують його по 0,5 г через 8 год. Аміноглікозиди звичайно вводять внутрішньом'язово, але у випадках важкого сепсису протягом 2-3 днів можливе внутрішньовенне крапельне введення. Разова доза препарату розводиться в 200 мл ізотонічного розчину натрію хлорида або 5% розчину глюкози, швидкість введення -60-80 крап. за хв.
Для підсилення антимікробного ефекту і розширення спектру дії антибіотики можна комбінувати між собою. При виборі комбінації препаратів необхідно враховувати характер їх взаємодії (індиферентний, синергічний або антагоністичний), ймовірну сумацію їхніх побічних дій і можливість внутрішньовенного введення хоча б одного з них. Найбільш вживаними поєданнями антибіотиків є: ампіциллін з оксациліном, природні і напівсинтетичні пеніциліни з аміноглікозидами, цефалоспорини з аміноглікозидами ((кефзол по 1,0 4 рази на добу внутрішньовенно та гентаміцин по 80 мг 3 рази на добу внутрішньом”язево).
Враховуючи поширеність анаеробної інфекції, в комплекс антибактерійних засобів слід включати препарати метронідазолу (по 100 мл 0,5% розчину 2-3 рази на добу). Досить ефективну дію проти анаеробів має кліндаміцин (далацин С), що вводять внутрішньовенно по 0,6-0,9 г з інтервалом 6-8 год.
З метою профілактики ДВЗ синдрому призначається трентал по 5,0 мл внутрішьовенно крапельно 1 раз на добу на 100 мл ізотонічного розчину натрію хлориду чи курантил 0,5 % 5,0 внутрішньовенно.
Призначення гепарину в комплексну терапію при гіперкоагуляції по 2,5 тис. ОД через 4 години чи фраксипарину по 7,5 тис.ОД 2 рази на добу. Лікування ДВЗ синдрому проводиться гематологом під контролем щоденної коагулограми.При геморагічному синдромі призначається свіжозаморожена плазма, кріприципітат, суха, нативна плазма та вводяться антифібринолітичні препарати (контрікал, гордокс).
Для покращення детоксикаційного ефекту в комплексну терапію включають екстракорпоральні методи детоксикації (табл.4). Вибір методу детоксикації залежить від тих завдань, які потрібно вирішити, враховуючи важкість хворої. Після гемосорбції значно знижується токсичність плазми. Поєднання комбінованої інфузійної детоксикаційної терапії та екстракорпоральної гемосорбції зменшує ендогенну інтоксикацію (Я.П.Сольський і співавт.,1990). Плазмофорез проводиться в період передопераційної підготовки та в післяопераційному періоді. Призначаються перорально ентеросорбенти.
Для лімфосорбції проводять дренування грудного лімфатичного протоку на шиї. Зібрану лімфу очищають сорбентами та вводять назад одну з вен. Деякі автори використовують гемосорбцію в поєднанні з УФО крові (Д.Ф.Костючек,1989).
Таблиця 4. Основні методи детоксикації, які використовують у хворих з генералізованими формами інфекції в гінекології.
| Назва методу | Гемосорбція | Плазмофорез | Лімфосорбція | Гіпербарична оксигенація (ГБО) | Ульрафіолетове опроміння аутокрові (УФО) |
| Механізм дії | Елімінація токсинів з крові шляхом її екстракорпоральної перфузії через сорбенти | Заміна токсичної плазми свіжою донорською чи нати-вною плазмою з поверненням власних форменних елементів в кровоносне русло | Елімінація токсинів з крові шляхом її екстракорпоральної перфузії через сорбенти | Ліквідація чи зменшення всіх форм кисневої недостатності організму | Фотомодифікація крові в результаті УФО |
| Показання | Наявність у хворих ендогенної інтоксикації і нирково-печінкової недостатності | Синдром ендогенної інтоксикації при перитоніті чи сепсисі | Наявність ендогенної інтоксикації | Гнійна інтоксикація. | Гнійна інтоксикація. |
| Ефект | Швидко знижує критичні показники порушень гомеостазукреатиніну, сечовини, білірубіну, збільшує погодинний діурез. Покращується стан ЦНС-у пацієнток зникає загальмованість, ейфорія, збудження. | В короткий термін виділити з організму хворої більшість продуктів метаболічних процесів. Сприяє вираженому зменшенню середніх молекул, некротичних тіл, циклічних імунних комплексів, протеолітичної активності крові | Детоксикаційний стійкий ефект, сприяє якісному покращенню дренажної функції лімфатичної системита евакуації дегенеративнозапальних елементів з зони запалення та некрозу, підвищує рівень основних імуноглобулінів | В результаті впливу на всі види гіпоксії покращується функція серцево-судинної системи, печінки, нирок, кишечника.Безпосередньо діють на збудників (анаеробні коки, кишкову, синьогнійну паличку), стимулює імунітет | Покращує реологічні властивості крові, фукцію серцевосудинної системи, знижує концентрацію середніх молекул, циркулюючих імунних комплексів, опосередковано покращує перистальтику кишечника |
| Недоліки | Повільно знижує вміст середніх молекул, некротичних тіл, циркулюючих імунних комплексів. До 3-5 дня лікування зменшується кількість еритроцитів, лейкоцитів, тромбоцитів на 10-40 %. | Є втрата лімфоцитів. Тривала лімфосорбція додатково пригнічує імунні реакції організму, що вимагає обов’язкової імунокорекції | Не відмічено | ||
| Спосіб застосування | Артеріовенозна чи веновеноза перфузія з попередньою гепаринізацією. Гемосорбцію проводять протягом 1,5-2 год з швидкістю 50-100 мл/хв з контролем АТ, пульсу, показників згортання крові. | Передує інфузійна терапія з метою створення помірної гемодилюції для виведення токсинів в кровоносне русло. Ексфузію крові здійснюють з периферичних катетеризованих вен без гепаринізацією в полімерні контейнери. В процесі плазмофорезу заміняють 2 л плазми, контролюють показники гемодинаміки, гематокриту, кількості еритроцитів. При важкому перебігу щоденно протягом перших 4-5 днів | Проводиться зовнішнє дренування грудного лімфатичного протоколу, який виділяється на протязі 1,5 см, береться на лігатури та катетеризується. Катетер діаметром до 0,8 см вводиться проти току лімфи без зусиль на 0,7-1 см і фіксується в безклапанній зоні протоку. Після дренування і отримання перших порцій лімфи для стимуляції лімфовідтоку проводять інфузійну терапію гіпертонічними розчинами та дезагрегантами | Сеанси в барокамері “Ока” тривалістю 45-60 хвилин в режимі 1,5-2 атм | 100-150 мл крові вводять в флакон з консервантом, протягом 20 хв опромінюють ультрафіолетом та оксигенують, потім прововодять реінфузію хворій |
Як відомо, боротьба з інфекцією включає в себе ліквідацію вогнища інфекції. При шоці, причиною якого є септичний аборт, деякі вчені рекомендують водночас з проведенням масивної протишокової і антибактеріальної терапії робити обережне інструментальне випороження матки (Гуртовой Б.Л. і ін.. 1981; Сольский Я.П. і ін., 1982; Макацария А.Д. і Добровольский В.И., 1986). Інші автори вказують, що маніпуляції в порожнині матки несприятливо впливають на перебіг шоку та погіршують прогноз. Клінічна практика показує: при шоці, особливо коли він розвивається на фоні позалікарняного аборту, інфекція часто не обмежується межами плідного яйця. Значно частіше в процес втягуються міометрій, маткові вени або інфекція виходить за межі матки. В таких випадках інструментальне видалення плідного яйця не призводить до ліквідації септичного вогнища.
У випадку інфікованого викидня раннього терміну без поширення запального процесу на міометрій та за межі матки можливе випорожнення порожнини матки шляхом обережного вишкрібання. Дане втручання є показаним при кровотечі. При пізньому викидні, що розпочався, ліквідація інфікованого плідного яйця здійснюється проведенням утеротонічноїтерапії крапельним внутрішньовенним введенням окситоцину або простагландинів; послід видаляєтся інструментальним шляхом.
Найбільш радикальним способом боротьби з вогнищем інфекції є видалення матки. До оперативного видалення матки слід підходити як до найважливішого, нерідко вирішального, етапу комплексного лікування шоку. Для одержання бажаного ефекту хірургічне втручання повинно здійснюватися своєчасно. На думку більшості вітчизняних і зарубіжних авторів, оперативне втручання проводиться при відсутності ефекту від інтенсивної консервативної терапії протягом 4-6 год. Операцією вибору є екстирпація матки з видаленням маткових труб, дренування параметріїв і черевної порожнини. В окремих випадках у хворих, що знаходяться у вкрай важкому стані, за відсутності макроскопічно виражених змін тканин матки допустимо проведення надпіхвової ампутації матки. Видалення маткових труб і дренування черевної порожнини обов'язкові і в цих випадках.
Хірургічне видалення джерел інфекції будь-якої локалізації у хворих при септичному шоці повинно робитися швидко і технічно правильно, тому подібних жінок повинні оперувати кращі фахівці установи.
Профілактикою ГНН є швидке і достатнє відновлення ОЦК з включенням в склад інфузійних середовищ реологічно активних рідини (реополіглюкін, неогемодез) з наступним внутрішньовенним введенням 10 мл 2,4% розчину еуфіліна, 2-4 мл 2% розчину но-шпи і 40-60 мг лазиксу.
Терапія ГНН починається з відновлення ОЦК, для чого використовуються розчини, що покращують мікроциркуляцію: поліглюкін, гемодез. Після цього призначають засоби, що знімають судинний спазм: кожні 4 год. вводять 5-10 мл 2,4% розчину еуфіліну і 2-4 мл 2% розчину но-шпи. Можна використати глюкозо-новокаїновую суміш (250 мл 20% розчину глюкози, 125-250 мл 0,25% розчину новокаїну і 12 ОД інсуліну). Паралельно з вазоактивними засобами застосовують діуретики. Салуретик лазикс вводять по 80-120 мг кожні 3-4 год. Осмодіуретик швидкої дії манніт вводять у вигляді 15% розчину в кількості 200 мл. При позитивній діуретичній дії інфузійна терапія призначається в залежності від кількостю сечі, що виділяється. У випадку відсутності ефекту на введення манніту темп вливання рідини слід обов'язково уповільнити, і для запобігання міжклітинного набряку паренхіматозних органів повторно осмодіуретики не застосовувати.
Кількість рідини, що вливається, обмежується при стійкій анурії на фоні відновленого ОЦК до 700-1000 мл/добу.
Для покращення виведення азотистих шлаків, поряд із заходами, що нормалізують функцію нирок, не слід забувати про такі прості способи, як промивання шлунку содовим розчином з наступним введенням альмагелю і сифонні клизми з розчином соди.
Консервативна терапія ГНН може бути застосована тільки при повільному темпі наростання азотемії. Загальноприйнятими показаннями до переведення хворої для гемодіалізу у відділення штучної нирки є: підвищення рівня калію в сиворотці крові більше 7 ммоль/л, рівня сечовини - більше 24 ммоль/л, рівня креатиніна -більше 1,32 ммоль/л, залишкового азоту -більше 107 ммоль/л (N-14-18 ммоль/л), гіпергідратація з явищами набряку легень і мозку, ознаки наростаючого ацидозу ( А.Н. Окороков, 1998).
Для профілактики і лікування гострої дихальної недостатності проводяться такі заходи: корекція водного балансу, що полягає, з одного боку, в своєчасному відновленні ОЦК, з іншого боку - в попередженні або усуненні гіпергідратації; підтримання необхідного рівня онкотичного тиску крові за рахунок введення білкових препаратів: своєчасне застосування глюкокортикостероїдної терапії; обов'язкове проведення кардіальної терапії і використання вазодилятаторів; адекватна оксигенація, при наростанні гіпоксії - своєчасний перехід на ШВЛ.
Таким чином, всі основні заходи, направлені на ліквідацію септичного шоку, сприяють ліквідації явищ гострої дихальної недостатності.
Критеріями ефективності комплексної терапії бактеріально-токсичного шоку є покращення свідомості хворої, зникнення ціанозу, потепління і порожевіння шкірних покровів, зменшення тахікардії і задишки, нормалізація ЦВТ і АТ, підвищення діурезу, ліквідація тромбоцитопенії. В залежності від важкості бактеріально-токсичного шоку, від своєчасності та адекватності проведення терапії нормалізація вище названих показників відбувається протягом декількох годин або декількох діб. Після виведення хворої з шоку в подальшому продовжується антибактеріальна, детоксикаційна і гемостимулююча імуностимулююча терапія, поповнюються енергетичні ресурси.
Після виписки з стаціонару хвора протягом 5 років знаходиться на диспансерному спостереженню для своєчасного виявлення і лікування можливих віддалених ускладнень перенесеного септичного шоку.
Профілактика. Висока летальність при септичному шоці, можливість розвитку важких ускладнень у хворих, що перенесли шок, свідчать про те, що проблема лікування важкого патологічного процесу є актуальною.
Септичний шок може ускладнити перебіг майже будь-якого інфекційного процесу, тому головним напрямком профілактики шоку є попередження виникнення і розвитку гнійно-септических захворювань вагітних, гінекологічних хворих. В жіночій консультації у вагітних необхідно виявляти і санувати вогнища інфекції.
У гінекологічних хворих необхідно своєчасно і раціонально проводити лікування септичних процесів внутрішніх статевих органів.
Перший, основний, напрямок складається з ранньої діагностики і адекватної терапії інфекційного захворювання. Недооцінка важкості інфекційного процесу призводить до недостатнього лікування і сприяє можливості виникнення шоку. Антибактеріальну терапію необхідно проводити з урахуванням характеру флори; дозування антибіотиків повинні бути оптимальними. Невід'ємною частиною терапії інфікованих викиднів є ліквідація вогнища інфекції. У жінок з наявністю інфікованого аборту вогнище інфекції повинне бути усунене якомога швидше. При інфекції в межах плідного яйця, в перші 12 тижн. вагітності вишкрібання порожнини матки повинно робитися відразу ж після поступлення хворої в стаціонар. При пізніх викиднях в подібній ситуації призначають утеротонічну терапію, а у випадку необхідності і за наявності умов робиться плодоруйнівна операція або інструментальне видалення посліду. При септичних викиднях, на думку більшості сучасних авторів, вогнище інфекції може бути ліквідоване шляхом інструментального видалення залишків в матці під прикриттям інтенсивної антибактеріальної і інфузійної терапії, що проводиться протягом 3-4 год. до втручання і триває до видужання. Лапаротомія і радикальне видалення вогнища інфекції показані у випадку відсутності ефекту від консевартивної терапії після інструментального видалення залишків плідного яйця в матці при важкому клінічному перебігу септичного аборту, в випадку перфорації матки, наявності перитоніту і гнійного процесу в придатках матки, у випадку підозри на некроз матки після введення лізолу, мила інших миючих засобів, при введенні в матку концентрованих розчинів калію перманганата, за наявності анаеробної інфекції.
Другий напрямок попередження септичного шоку у хворих високого ризику складається з профілактичного застосування гепарину та включення в комплексну терапію препаратів, що покращують реологічні властивості крові. Гепарин вводять підшкірно по 5000 ОД кожні 8-12 год. під контролем часу згортання крові. При передозуванні препарату використовується антагоніст гепарину - протаміну сульфат, 0,1 мл 1% розчину якого нейтралізує 100 ОД гепарину.
АНАФІЛАКТИЧНИЙ ШОК
Анафілактичний шок належить до першого типу негайної підвищеної чутливості, це бурхлива реакція, яка може виникати після введення в організм будь-яких речовин, особливо протеїнів.
Патогенез. За своєю патофізіологією анафілактичний шок є істинним шоком, оскільки включає дисеміновану внутрішньосудинну коагуляцію, яка пояснює багато його клінічних ознак. Комплекс антиген - антитіло має тромбогенні властивості. Спочатку анафілактичний шок описували в зв’язку із сенсибілізацією організму до гетерогенних білків. Серед лікарських препаратів, які мають білкову, вуглеводну або полісахаридну структуру, слід згадати сироватки, білкові гормони, ензими і антиензими, гепарин і декстрани, білкові гідролізати, антибіотики, місцеві анестетики, саліцилати, йодисті контрастні речовини. Анафілактичний шок розвивається через кілька хвилин після проникнення алергена в організм і проявляється генералізованим свербінням шкіри, кропивницею, спазмом гладеньких м'язів (зокрема бронхів), втратою свідомості, різким падінням артеріального тиску. Чим менший інтервал між введенням в організм алергену і початком шоку, тим важчий його клінічний перебіг. Якщо хворому своєчасно не надати допомогу, можливий летальний наслідок. Термін часу, який минув з моменту припинення попереднього призначення алергену до повторного призначення називають інтервалом ризику. Цей проміжок часу коливається від трьох днів до кількох років. Антитіла циркулюють вільно, але можуть затримуватись в клітинах , оскільки вони є специфічними імуноглобулінами. Комплекси антиген - антитіло є преципітуючими макромолекулами, які, відкладаючись на ендотеліальних клітинах, зумовлюють процес дисемінованої внутрішньосудинної коагуляції мікроциркуляторного русла.
Істинна патогенетична ланка анафілактичного шоку знаходиться в проміжних вазоактивних речовинах, які виділяються під час конфлікту між антигеном і антитілом. Гладенькі м’язові клітини мікроциркуляції бронхіол і кишечника є прицільними клітинами, ефектори яких виконують інформацію активних амінів, які раптово потрапляють в кров’яне русло. Виникнення анафілактичного шоку включає такі етапи: імулогічний (конфлікт між антигеном і заздалегідь утвореним антитілом), біохімічний (потік вазоактивних речовин, які негайно активуються конфліктом антиген-антитіло), і вісцеральний, який проявляється анатомоклінічно.
Введений в організм, з яким він вже був в контакті, антиген різко зв’язується з антитілами (циркулюючими і/або клітинними), їх конфліктне сполучення викликає втрату зернистості мастоцитів, розкладання тромбоцитів і пускає в хід, активізуючи системи коагулостату. В кров раптово потрапляють гістамін, серотонін, брадикінін, ацетилхолін, гепарин, простагландини, аденілати, калій, slow reacting substances.
При посттрансфузійному (анафілактоподібному) шоці, внаслідок конфлікту антиген-антитіло виділяється і тромбопластичний ліпопротеїн (еритроцитин), який викликає лізис еритроцитів.
Клініка. Симптоматика анафілактичного шоку полягає в розлитій реакції з боку периферичного кровообігу, яка супроводжується різким падінням артеріального тиску, нерідко - закупорюванням бронхіол з нападами астми, набряком гортані, кропивницею, набряком Квінке, неврологічними та шлунково-кишковими проявами і навіть алергічним міокардитом, який вторинно може викликати стан шоку.
Таким чином, розрізняють кілька клінічних форм анафілактичного шоку: дихальні, шкірні, серцеві, травні, неврологічні, геморагічні. Але у всіх цих формах на першому плані - судинні та гемореодинамічні прояви.
Клініка анафілактичного шоку досить різноманітна: існують передвісники, спостерігаються надгостра форма блискавичного колапсу і виражена класична форма, іноді - невиражені, односимптомні або епізодичні форми. Перебіг анафілактичного шоку – швидкий, смерть настає іноді через кілька хвилин внаслідок зупинки серця і дихання або через 10-15 хв внаслідок асфіксії. Форми середнього або легкого ступеню важкості розвиваються протягом 15-20 хв або тривають кілька годин.
Часто після первинного введення білкових (вакцина, молоко) і колоїдних речовин (декстран, желатин, кров, полівінілпіролідон і т.д.) або після вживання консервованих харчових продуктів, які утворюють гістамін, з'являється клінічна картина, подібна до анафілактичного шоку. Ці патологічні ситуації беруть початок безпосередньо з біохімічної ланки вазоактивних речовин і отримали різні назви: колоїдоклазичний шок, протеїновий шок, гістаміновий шок, гемотрасфузійний шок.
Всі ці типи шоку можна назвати загальним терміном "анафілактоподібний шок". Його лікують так само, як і істинний анафілактичний шок.
При анафілактичному шоці велике значення мають вхідні ворота (парентеральне чи оральне введення речовини), кількість введеної речовини, інтервал часу від попередньої алергізації, генетична структура хворого. Термін реакції при анафілактичному шоці важкого ступеня - менше 10-15 хв, у більшості випадків до 30 хв, іноді триває від однієї до кількох годин.
Принципи лікування. Перша допомога полягає насамперед в припиненні подальшого потрапляння алергена в організм (відміна лікарського середника, усунення іншого фактора). При можливості накладають джгут вище місця ін’єкції, ділянку підшкірної ін”єкції обколюють 0,5 мл 0,1 % розчину адреналіну. Необхідно забезпечити постійний доступ свіжого повітря, попередити западання язика та аспірацію блювотних мас. З метою підвищення артеріального тиску підшкірно або внутрішньом”язово вводять адреналін, норадреналін, або мезатон. Для забезпечення швидкого всмоктування їх доцільно вводити в різні ділянки тіла по 0,5 мл кожних 10-15 хвилин до виведення хворого із шокового стану. Додатково для стимуляції судинорухового та дихального центрів рекомендуються пішкірні ін'єкції 1-2 мл кордіаміну або 1-2 мл 10 % розчину кофеїну. Антигістамінні засоби починають застосовувати після нормалізації артеріального тиску для зняття або попередження шкірних висипань. Для купірування бронхоспазму внутрішньовенно вводять 5-10 мл 2,4 % розчину еуфіліну в 10 мл ізотонічного розчину хлориду натрію або 10-20 мл 20 % або 40 % розчину глюкози. Кортикостероїдні препарати (гідрокортизону гемісукцинат - 100 мг, преднізолону фосфат або гемісукцинат - 60 мг) призначають внутрішньом'язово, а у важких випадках внутрішньовенно струминно в ізотонічному розчині глюкози або хлориду натрію. Терапія анафілактичного шоку повинна включати засоби, які забезпечують знешкодження біохімічних речовин, що виділяються внаслідок конфлікту антиген-антитіло, а також їх дію на прицільні клітини. При надгострих формах застосовують безпосередньо катехоламіни, а при підгострих формах слід використовувати лікувальну схему типового шоку, беручи до уваги, що основним предметом цього лікування є гіповолемія. В обох випадках призначають кортикостероїдні гормони (кортизон з розрахунку 10 мг/кг маси тіла). Ефективними є інгібітори гістидиндекарбоксилази і 5-гідрокситриптофандекарбоксилази (гіпостамін, інгібостамін). З метою здійснення блокади фібринолізу можна призначати антиплазміни, а для боротьби з активацією протеаз – антиензими (гордокс, контрикал, трасилол).
Застосування лікування, яке безперервно корегується клінічним перебігом синдрому, полягає в послідовності таких заходів:
- Негайно після появи перших ознак анафілактичного шоку накладають джгут (на 20-30 хв) на основу кінцівки, в яку було зроблено ін’єкцію, що потенційно могла викликати анафілактичний шок.
- Внутрішньовенно необхідно ввести розчин 1 мл 0,1 % розчину норадреналіну. При зупинці серця застосовують інтракардіальне введення адреналіну. Потрібно використовувати моніторний запис ЕКГ. Всі дози препаратів призначають повторно, орієнтуючись на клінічний перебіг шоку.
- Виконують катетеризацію однієї з центральних вен, проводять трансфузію ізотонічних сольових розчинів та стероїдних гормонів.
- Проводять аспірацію вмісту ротової порожнини та трахеї (іноді необхідно виконати інтубацію трахеї або трахеостомію і призначити введення зволоженого кисню).
Профілактика анафілактичного шоку полягає у ретельному збиранні анамнезу: перед призначенням лікарського середника необхідно з'ясувати, чи застосовувався даний препарат чи інші засоби цієї групи в минулому і чи супроводжувалось введення препарату будь-якою реакцією. В кожному медичному закладі повинна бути “протишокова аптечка”, до складу якої входять два джгути, стерильні шприци, 0,1 % розчин адреналіну, 0,2 % розчин норадреналіну, 1 % розчин мезатону, 2,4 % розчин еуфіліну, 10 % розчин кофеїну, 0,05 % розчин строфантину або 0,06 % розчин корглюкону, кордиамін, антигістамінні зособи в ампулах, флакони з ізотонічним розчином хлориду натрію та глюкози. Медперсонал повинен володіти методами надання невідкладної допомоги при анафілактичному шоці.
Шокова печінка. Печінка – це найбільша залоза організму, яка виконує багато функцій, найважливішими з яких є метаболічна, екскреторна та бар’єрна. В печінці здійснюється синтез білків (утворюється альбумін, основні фактори згортання крові та ін.) та відбувається найбільш інтенсивний їх розпад. Печінка бере участь в обміні амінокислот, синтезі глутаміну, креатиніну, сечовини. Важливу роль печінка відіграє в обміні ліпідів, який тісно пов”язаний з її жовчовидільною функцією. Печінка бере активну участь в проміжному обміні вуглеводів, обміні гормонів, біогенних амінів, вітамінів, мікроелементів, забезпечує їх депонування та інактивацію.
Завдяки екскреторній функції печінки з організму виділяються з жовчю сполуки, синтезовані в самій печінці, жовчні кислоти, виведені з крові, холестерин, фосфоліпіди, білірубін та ін.
Бар’єрна функція печінки спрямована на попередження пошкоджуючого впливу чужорідніх агентів і продуктів метаболізму, збереження гомеостазу організму. Бар'єрна функція здійснюється за рахунок захисної та знешкоджуючої дії печінки. Захисна функція забезпечується неспецифічними та специфічними (імунними) механізмами.
У всіх випадках складних уражень печінки пошкоджуються деякі зони паренхіми, які містять в собі ряд судинних та жовчних елементів. Незалежно від типу шоку, печінка намагається нормалізувати метаболічні порушення і лише після втрати всіх своїх функцій (понад 500) ураження шокової печінки перетворюється в ураження всього організму.
Якби не була “задушена” відсутністю подачі кисню величезна колонія гепатоцитів, навіть під час термінальних стадій шоку зберігаються функціональні можливості печінки. Ще в 1971 році Hift i Strawitz довели, що в передагональній стадії шоку мітохондрії гепатоцитів собаки прекрасно “дихають” в сукцинаті натрію в апараті Warburg-а . З того часу було проведено багато досліджень, результати яких свідчать про те, що організм гине з ще життєздатною печінкою на функціональному клітинному рівні.
І все ж нерідко в шоковому стані втрачаються одна за одною функції шокової печінки до виникнення жовтяниці реактивного типу з підвищеним вмістом прямого білірубіну та лужної фосфатази, що свідчить про несприятливий прогноз для хворого, оскільки білігенетична функція гепатоцитів філогенетично є найбільш давньою і втрачається останньою. Найчастіше жовтяниця спостерігається при інфекційно-токсичному шоці, під час якого функція гепатоцитів порушується не лише внаслідок вираженої гіпоксії, але й в результаті впливу ендотоксинів. Ураження печінки виникає через кілька годин і триває кілька днів залежно від розвитку шоку. Пошкодження гепатоцитів починається функціональними розладами і завершується розвитком морфологічних рубців. Біохімічно можна виявити розлади факторів коагуляції, білкових фракцій та амінокислот, сечовини, аміаку та сечової кислоти. При дослідженні крові, яка витікає з гіпоксичної печінки, встановлено виражене підвищення вмісту трансаміназ, лактатдегідрогенази, лужної фосфатази.
При шокових станах артеріальний кровотік в печінці знижується до 40-30 % в порівняні з нормальним. Внутрішньопечінкова вазоконстрикція з’являється в першій стадії шоку, що викликає перешкоду в артеріальній та портальній системах і призводить до гіпоксії печінки.
Шокова підшлункова залоза. Підшлункова залоза є головним генератором гідролаз організму. При шокових станах потік гідролаз з пошкоджених лізосом панкреатичних клітин транспортальним кров”яним або лімфатичним шляхом потрапляє в загальне кров'яне русло. Гідролази в надмірній кількості являють собою фундаментальний фактор розладів коагулолітичної та кінінової систем рідкої крові. В панкреатичному просторі зароджується пригнічуючий міокард фактор, який згубно впливає на діяльність серця. Будь-який фактор, що порушує звичайну функціональну архітектоніку підшлункової залози, зумовлює виникнення низки патофізіологічних проявів, характерних для шокового стану. Гіпертонія в канальцях і розлади утворення хілусу призводять до появи першої біохімічної ланки, так званого кіназного шоку: спочатку місцева, а потім генералізована активація протеаз у всій плазмі. Це стадія гострої панкреатичної ензимопатії, яка зумовлює виникнення картини шоку. Друга біохімічна ланка залежить від попередньої: активація протеаз одночасно зумовлює розвиток фактора Hageman-а і активаторів фібринолізу. Зокрема, трипсин є безпосереднім активатором факторів Y, YIII, X. Таким чином, запускається механізм розвитку ДВЗ-синдрому.
Шокова нирка. Нирка є одним з життєво важливих органів, в яких при шоковому стані порушується мікроциркуляція. Ураження нирки проявляється дуже швидко олігоанурією, яка може продовжуватись і після нормалізації артеріального та центрального венозного тиску, тому неможливо передбачити еволюцію шокової нирки. За винятком посттрансфузійного шоку та синдрому роздавлювання, наслідки яких безпосередньо викликають первинні ураження нирок, при інших типах шоку ураження нирки зумовлене механізмом передниркової недостатності внаслідок порушення специфічного для шоку розладу системної гемодинаміки.
В більшості шокогенних ситуацій після різного терміну олігоанурії поступово відновлюється діурез, однак функція концентрації і регулювання кислотно-лужної рівноваги ще деякий час залишається недостатньою. Прихована ниркова недостатність, яка існує ще до шокогенної агресії, сприяє розвитку шокової нирки.
Незалежно від того, чи первинним фактором є гостра гіповолемія, як це буває при геморагічному шоці, чи гіперергічна вазоконстрикція в мікроциркуляторному руслі, як це відбувається при травматичному, анафілактичному або інфекційно-токсичному шоці, внутрішньониркові ураження мають ідентичний характер. Регулювання циркуляторного режиму в нирці в умовах шоку здійснюється привідними судинами юкстамедулярних клубочків, артеріовенозними анастомозами і юкстамедулярними шунтами. Якщо ішемія продовжується деякий час, виникають некротичні зміни в канальцях.
Гостра ниркова недостатність (ГНН), яка виникає внаслідок шокового стану, особливо важка, в результаті своєї катаболічної фази, є специфічної для постагресивного гіперергічного синдрому (Burghele). Під час цієї фази глюкокортикоїди надниркових залоз посилюють катаболізм, спричиняючи виражене руйнування клітин, яке супроводжується протеолізом і проявляється підвищеною концентрацією азоту в крові. Надмірна кількість мінералокортикоїдів також зумовлює розвиток шокової нирки, викликаючи появу гіперальдостеронового синдрому із затримкою іонів натрію і води, що сприяє посиленню навколоканальцевого набряку і спричиняє погіршення стану шокової нирки. У виникненні шокової нирки бере участь і антидіуретичний гормон, який виділяється раптово і викликає негайну реакцію з боку організму. Виділяють такі клінічні стадії шокової нирки: початкова, поява анурії і відновлення діурезу.
Початкова стадія. В клінічній картині переважає больовий синдром. Артеріальний тиск залишається на нижній межі норми, але вазоконстрикція в мікроциркуляторному руслі клубочків проявляється олігурією і зумовлює зниження кількості сечі до 500 мл за добу і менше. Безбілковий азот коливається біля максимально допустимої межі. В цій стадії доцільно слідкувати за діурезом (похвилинним або погодинним), зниження діурезу менше 30 мл/год вказує на можливість розвитку шокової нирки. Якщо з допомогою альфа-блокаторів та кортикостероїдів вдається підвищити діурез, можна вважати, що ГНН мала функціональний характер і її наступний перебіг залежить від еволюції шоку. ГНН вважають функціональною, якщо нирка зберігає концентрацію сечовини понад 10 г/добу, питома вага сечі більша 1,012, виділення калію сечею ефективне.
Стадія анурії. Виникають некротичні ураження канальців. Нирка виділяє малу кількість сечі, спостерігається ізостенурія, показники сечовини низькі (менше 5 г/добу), концентрація калію невисока. Стадія анурії може тривати від 3 до 30 днів.
Найбільш важливі клінічні ознаки: сонливість, затьмарення свідомості, галюцинації, марення – залежать від набряку мозку; серцевосудинні ознаки виникають внаслідок уремічного міокардиту і проявляються аритмією, розвивається уремічний перикардит; порушення функцій органів травлення проявляються анорексією, нудотою, блюванням. З'являються розлади коагулолітичного механізму з виникненням ДВЗ-синдрому. Спостерігаються гіперкаліємія, загальна гіпергідратація, особливо при парентеральному введенні надлишку рідини, метаболічний ацидоз.
Стадія відновлення діурезу. Якщо відсутні незворотні зміни при ураженні ниркових канальців відновлюється діурез. Цей період коливається від 3 до 30 днів. В перші дні сеча гіпостенурична, концентрація сечовини в сечі нижче 1г/л. Через кілька днів кількість сечі становить до 2 – 4 л за добу, її питома вага залишається низькою, вміст сечовини в сечі теж невисокий. Це – стадія поліуричної ниркової недостатності, в якій необхідно приділяти увагу підтримці адекватного водного балансу.
Ускладнення. Інфекційні ускладнення спостерігаються досить часто внаслідок використання зондів та катетерів для введення в вену та сечовий міхур. При наявності в середовищі великої кількості штамів збудників, стійких до дії широкозастосовуваних антибіотиків, ризик інфікування значно підвищується.
Ускладнення геморагічного характеру з’являються в результаті виникнення ДВЗ – синдрому, зокрема коагулопатії споживання. В клінічній картині переважають гідроіонні розлади, особливо гіпергідратація та гіперкаліємія.
Клінічна та біологічна картина при шоковій нирці відрізняється від картини при чистій нирковій недостатності, оскільки шокова нирка супроводжується симптомокомплексом синдрому постагресивної реакції. Так, швидке підвищення вмісту сечовини в крові вказує на існування низки екстраренальних факторів, які викликають появу вираженого протеолізу тканин. Під час першої стадії шоку метаболічинй ацидоз може поєднуватися з вентиляційним алкалозом, а гіперкаліємія буває відсутньою при втраті калію внаслідок вираженого блювання.
- гостре захворювання канальців із збереженням діурезу; стабільність артеріального тиску нижче рівня отримання клубочкового фільтрату зумовлює спочатку “оціпеніння” ниркових канальців з некрозом різних розмірів, яке може бути зворотним протягом 24 – 40 годин;
- кортикальний некроз зустрічається значно рідше, але є важкою формою ураження внаслідок незворотної анурії та наявності морфологічних залишкових явищ.
Незворотні ураження з’являються при тривалій дії шокогенних факторів. Кортикальний некроз є наслідком спазму привідних клубочкових артерій із застоєм та внутрішньокапілярними відкладеннями фібрину.
Шокові легені. Поняття “шокова легеня” зумовлене ураженнями, які виникають первинно в легеневій системі при шоці будь-якої етіології. Для шокової легені характерна така тріада:
- недостатня оксигенація крові внаслідок дії шунтування справа наліво;
- підвищення легеневої резистентності (т.з. легеневий бар’єр);
- набряк легеневої інтерстиціальної тканини (“мокра легеня”).
Легені являють собою прицільний орган, оскільки йому належить важлива роль в активації фібринолізу і вона елективно реагує на дію джерела екстрапульмонального гістаміну.
Чутливість шокової легені пов’язана з такими патологічними факторами:
- виникненням ДВЗ-синдрому в ділянці легеневої мікроциркуляції;
- тромбоцитарною та жировою емболіями;
- дисфункцією сурфактанту;
- накопиченням кристалоїдів в інтерстиціальному просторі легені (мокра легеня).
Вищевказані розлади призводять до таких наслідків:
- невідповідність перфузії – вентиляції з наступним шунтуванням справа наліво;
- зниження об’єму легень при зміні тиску на одиницю об’єму;
- зниження парціального артеріального тиску кисню і підвищення парціального артеріального тиску вуглекислого газу;
- підвищення резистентності легень;
- поява зон гіперемічного ателектазу, інтерстиціальних та внутрішньоальвеолярних кровотеч;
- розвиток легеневої гіпертензії, яка супроводжується серцевою недостатністю та підвищенням центрального венозного тиску (ЦВТ).
Поява ДВЗ-синдрому в легенях зумовлює закупорювання мікроциркуляторного русла легень, внаслідок чого виникає шунтування і з'являється кровотеча в інтерстиціальній тканині та альвеолах з наступним ателектазом; одночасно розвивається гіаліноз базальних мембран із зниженням об’єму легень при кожній зміні тиску на одиницю об’єму.
Виділення тканинних вазоактивних речовин (гістамін, серотонін, брадикінін та ін.) викликають появу гіперемічного інтерстиціального набряку. Легеневий простагландин Е2 діє анологічно гістаміну, зумовлюючи спазм бронхіол та ателектаз альвеол.
Тромбоцитарно-жирові емболії мають специфічну динаміку:
- негайно з’являються жирові кульки у випадку кістково-суглобових травм;
- пізно з’являються жирові кульки при підвищеній кількості в плазмі загальних жирів (тригліцеридів);
- тромбоцитарні дрібні тромби розміром понад 7 – 10 нм затримуються в сітці легеневого фільтру, вони виникають, як правило, у великій кількості через 3 доби від початку шоку;
- різноманітні домішки інфузійних розчинів, зокрема препаратів крові, затримуються легеневим фільтром.
Надзвичайно небезпечною є емболія основного стовбура легеневої артерії. Частота випадків, виявлених при розтинах, складає 10 % серед всіх причин смерті. Тривалість клінічного перебігу легеневої емболії, за даними різних авторів, коливається від 10 хвилин до 2 тижнів. Характерними клінічними ознаками є різка гіпотонія, швидкий і слабкий пульс, холодні шкірні покриви, значно підвищений ЦВТ, набухання яремних вен, ритм галопу в правій ділянці серця. Доцільними є рентгенографія легень, ЕКГ, артеріографія, термографія, ехографія. Для лікування використовують лише фібринолітичні засоби, оскільки антикоагулянти можна застосовувати лише в першу фазу ДВЗ-синдрому або з профілактичною метою.
Хірургічне лікування при емболії основного стовбура легеневої артерії показане в таких випадках:
- зупинка серця;
- артеріальний тиск нижчий 100 – 80мм рт.ст.;
- тахіпное у поєднанні з вираженою десатурацією кисню в артеріальній крові, що вказує на важкість розладів вентиляції-перфузії;
- повторна емболія.
При біохімічному дослідженні плазми шокового хворого виявлено фактор, пригнічуючий сурфактант, який пригнічує синтез і знижує якість сурфактанту, що, в свою чергу, зменшує альвеолярну вентиляцію.
“Мокра легеня” так, як і при шоковій печінці, зазвичай, збільшується маса шокової легені. В нормі іони натрію не проникають крізь оболонку легеневого капіляра, при шоку вони накопичуються в інтерстиціальній тканині, підвищуючи осматичний тиск в ній. Внаслідок цього відбувається накопичення рідини в інтерстиції. Необхідно коригувати регіонарний дизбаланс в ділянці легеневого інтерстицію, оскільки “мокра легеня” не обов'язково є проявом загальної дегідратації.
Варто пам'ятати про токсичну дію кисню при призначенні його довше критичного терміну. Внаслідок цього ендотелій альвеол та внутрішньокапілярні еритроцити піддаються лізису шляхом пероксидації.
Принципи лікування:
- Звільнення дихальних шляхів (за допомогою бронхоскопа), отриманий матеріал відправляється на бактеріологічне дослідження та для отримання антибіотикограми.
- Керована вентиляція легень (при парціальному артеріальному тиску кисню менше 60 мм рт.ст. необхідно виконати трахеостомію).
- Строгий контроль за кількістю інфузійної рідини, призначення антибіотиків широкого спектра дії.
- Судинорозширюючі засоби, які впливають на легеневу мікроциркуляцію.
- Визначення інфузійних засобів проводять під строгим контролем концентрації електролітів в крові.
- Призначають діуретичні засоби швидкої дії (шляхом внутрішньовенного їх введення).
МАТКОВІ КРОВОТЕЧІ І ГЕМОРАГІЧНИЙ ШОК
Маткові кровотечі виникають внаслідок різноманітних причин, але у будь-якому випадку вимагають надання невідкладної допомоги. Однією з найбільш частих причин маткової кровотечі є самовільний викидень (аборт). Причинами самовільного переривання вагітності можуть бути серцево-судинні захворювання, гострі та хронічні інфекції, інфантилізм, ендокринні порушення і т.д. Самовільний викидень супроводжується переймоподібним болем внизу живота і значною матковою кровотечею. В перебігу самовільного аборту розрізняють такі стадії: загроза викидня; викидень, що почався; викидень "в ходу"; неповний викидень; повний викидень.
Діагностика. Встановити діагноз переривання вагітності неважко. Стадію викидня можна визначити за станом шийки матки. При аборті, що почався, виникає часткове відшарування плідного яйця від стінок матки, що призводить до появи кров'янистих виділень із статевих шляхів. Шийка матки при цьому вкорочена, зовнішнє вічко закрите, відмічається переймоподібний біль внизу живота. При аборті "в ходу" шийка матки вільно пропускає палець, іноді за внутрішнім вічком можна визначити плідне яйце. В деяких випадках плідне яйце пальпується в цервікальному каналі. При цьому спостерігаються значна кровотеча та переймистий біль внизу живота.
При неповному аборті ембріон виганяється з порожнини матки, але в матці залишаються частини плідного яйця, які зумовлюють продовження досить значної кровотечі. Шийка матки набуває звичайної конфігурації, хоча зовнішнє вічко дещо привідкрите. Переймоподібний біль менш інтенсивний. В деяких випадках плідне яйце може повністю відшаруватися і виділитися з матки. В такому випадку пацієнтка не потребує допомоги.
Лікування. Невідкладна допомога необхідна при наявності аборту "в ходу" або неповного аборту. В ургентному порядку слід провести інструментальну ревізію стінок матки з метою видалення залишків плідного яйця та децидуальної оболонки. Операцію потрібно виконувати під загальним знеболюванням шляхом внутрішньовенного введення кетанесту, кеталару, кетаміну та ін. або парацервікальної анестезії новокаїном чи лідокаїном. Перед вишкрібанням обов'язково слід провести зондування матки з метою визначення довжини матки і попередження її перфорації. Додатково розширяти цервікальний канал не потрібно. Після видалення залишків плідного яйця матка скорочується і кровотеча припиняється. Аборт "в ходу" і неповний аборт завжди супроводжуються анемізацією та інфікуванням, тому таким хворим необхідно призначити протианемічну, антибактеріальну та десенсибілізуючу терапію з метою профілактики розвитку генералізованої інфекції.
Причиною маткової кровотечі можуть бути гормональні розлади на різних рівнях регуляції менструальної функції, а також вузлувата фіброміома матки при субмукозній локалізації міоматозних вузлів. Патогенез та діагностика цих захворювань описані у відповідних розділах. При дисфункціональних кровотечах дітородного та клімактеричного віку з метою зупинки кровотечі необхідно провести вишкрібання слизової оболонки матки, призначити утеротонічні, кровозупинні засоби, при необхідності - гормональний гемостаз. При ювенільних маткових кровотечах проводять симптоматичну терапію. Вишкрібання слизової оболонки матки виконують лише за життєвими показаннями. Іноді маткова кровотеча може бути спричинена субмукозним міоматозним вузлом на ніжці, який народжується. В такому випадку виконують операцію викручування міоматозного вузла. В післяопераційний період проводять утеротонічну, гемостатичну, антианемічну терапію.
Терміном "геморагічний шок" визначається стан, пов'язаний з гострою і масивною кровотечею, що супроводжується різким зниженням обсягу циркулюючої крові (ОЦК), серцевого викиду і тканинної перфузії внаслідок декомпенсації захисних механізмів і реакцій організму.
Синдром ДВЗ крові є неспецифічною реакцією системи гемостазу, що супроводжує різноманітні критичні стани організму. Він проявляється активізацією коагуляційної ланки гемостазу з утворенням численних тромбів в системі мікроциркуляції і підвищенням фібринолізу.
Синдром ДВЗ крові патогенетично тісно пов'язаний з геморагічним шоком. Гострий синдром ДВЗ крові, з одного боку, є ускладненням важкого геморагічного шоку, з іншого - хронічна і підгостра форми ДВЗ крові, що зустрічаються при деяких формах гінекологічної патології, сприяють швидкому розвитку шоку.
Патогенез. До розвитку шоку зазвичай призводять геморагії, що перевищують 1000 мл, тобто втрата становить більше 20 % ОЦК або 15 мл крові на 1 кг маси тіла. Тривала кровотеча, що перевищує 1500 мл (понад 30 % ОЦК), вважається масивною і безпосередньо загрожує життю жінки.
Незалежно від причини масивної кровотечі, в патогенезі геморагічного шоку провідною ланкою є диспропорція між зменшеним ОЦК і ємністю судинного русла, що спочатку проявляється порушенням макроциркуляції, тобто системного кровообігу. Після цього з'являються мікроциркуляторні розлади, внаслідок яких розвиваються прогресуюча дезорганізація метаболізму, ферментативні порушення і протеоліз.
Систему макроциркуляції утворюють артерії, вени і серце. До її складу входять артеріоли, венули і артеріовенозні анастомози. Як відомо, приблизно 70 % усього ОЦК знаходяться в венах, 15 % - в артеріях, 12 % - в капілярах, 3 % - в камерах серця.
При крововтраті, що не перевищує 500 - 700 мл, тобто близько 10 % ОЦК, відбувається компенсація за рахунок підвищення тонусу венозних судин, рецептори яких найбільш чутливі до гіповолемії. При цьому істотно не змінюються артеріальний тонус, частота серцевих скорочень, перфузія тканин. Така крововтрата призводить до значної гіповолемії, що є сильним стресовим фактором. Для підтримання гемодинаміки життєво важливих органів (перш за все мозку і серця) включаються потужні компенсаторні механізми: підвищується тонус симпатичної нервової системи, збільшується викид катехоламінів, альдостерону, АКТГ, антидіуретичного гормону, глюкокортикоїдів, активується ренін-гіпертензивна система. За рахунок цих механізмів відбуваються прискорення серцевої діяльності, затримка виділення рідини і притягнення її в кровоносне русло з тканин, спазм периферичних судин, розкриття артеріовенозних шунтів. Механізми, що призводять до централізації кровообігу, тимчасово підтримують хвилинний обсяг серця і артеріальний тиск. Однак централізація кровообігу не може забезпечити тривалої життєдіяльності організму жінки, бо здійснюється за рахунок порушення периферійного кровотоку.
Кровотеча, що не зупиняється, призводить до виснаження компенсаторних механізмів і поглиблення мікроциркуляторних розладів за рахунок виходу частини крові в інтерстиційний простір, згущення крові, різкого сповільнення кровотоку з розвитком сладж-синдрому, що спричиняє глибоку гіпоксію тканин з розвитком ацидозу та інших метаболічних порушень. Гіпоксія і метаболічний ацидоз викликають порушення функції "натрієвого насоса", натрій та іони водню проникають всередину клітин, витісняючи іони калію і магнію, що призводить до підвищення осмотичного тиску, гідратації і пошкодження клітин. Послаблення перфузії тканин, нагромадження вазоактивних метаболітів сприяють стазу крові в системі мікроциркуляції і порушенню процесів згортання з утворенням тромбів. Відбувається секвестрація крові, що призводить до подальшого зниження ОЦК. Різкий дефіцит ОЦК порушує кровопостачання життєво важливих органів. Знижується коронарний кровотік, розвивається серцева недостатність. Такі патофізіологічні зміни (в тому числі порушення згортання крові з розвитком синдрому ДВЗ) свідчать про тяжкість геморагічного шоку.
Ступінь і час дії компенсаторних механізмів, вираження патофізіологічних наслідків масивної крововтрати залежать від багатьох факторів, зокрема від швидкості крововтрати i вихідного стану організму жінки. Гіповолемія, навіть значна, при повільному розвитку не викликає катастрофічних порушень гемодинаміки, хоча спричиняє настання незворотного стану. Невеликі повторні кровотечі тривалий час можуть компенсуватися організмом. Однак компенсація надзвичайно швидко призводить до глибоких і незворотних змін тканин і органів.
Клінічна картина. За Рябовим Г.А. (1983), в клініці геморагічного шоку виділяють такі стадії:
I стадія - компенсований шок;
II стадія - декомпенсований зворотний шок;
III стадія - незворотний шок.
Стадії шоку визначаються на основі оцінки комплексу клінічних проявів крововтрати, які відповідають патофізіологічним змінам в органах і тканинах.
І стадія геморагічного шоку (синдром малого викиду, або компенсованого шоку) звичайно розвивається при крововтраті близько 20 % ОЦК. В цій стадії компенсація втрати ОЦК здійснюється за рахунок гіперпродукції катехоламінів. В клінічній картині переважають симптоми, що свідчать про зміну серцево-судинної діяльності функціонального характеру: блідість шкірних покривів, запустіння підшкірних вен на руках, помірна тахікардія до 100 уд. за хв, помірна олігурія і венозна гіпотонія. Артеріальна гіпотонія буде відсутня або слабовиражена.
Якщо кровотеча припинилася, то компенсована стадія шоку може тривати досить довго. При тривалій крововтраті відбувається подальше поглиблення розладів кровообігу і настає наступна стадія шоку.
ІІ стадія геморагічного шоку (декомпенсований зворотний шок) розвивається при крововтраті, що відповідає 30 - 35 % ОЦК (від 25 до 40 %). В цій стадії шоку відбувається поглиблення розладів кровообігу. Знижується АТ, оскільки високий периферичний опір за рахунок спазму судин не компенсує малий серцевий викид. Порушується кровопостачання мозку, серця, печінки, нирок, легень, кишечника, внаслідок чого розвиваються тканинна гіпоксія і змішана форма ацидозу, що вимагає корекції. В клінічній картині, окрім падіння АТ (менше 100 мм рт.ст.) і амплітуди пульсового тиску, мають місце виражена тахікардія (120 - 130 уд. за хвилину), задишка, акроціаноз на фоні блідості шкірних покривів, холодний піт, неспокій, олігурія нижче 930 мл/год), глухість серцевих тонів, зниження ЦВТ.
ІІІ стадія шоку (декомпенсований незворотний шок) розвивається при крововтраті близько 50 % ОЦК (від 40 до 60 %). Його розвиток визначається подальшим порушенням мікроциркуляції: капіляростазом, втратою плазми, агрегацією формених елементів крові, наростанням метаболічного ацидозу. Систолічний АТ падає нижче критичних цифр. Тахікардія понад 140 уд. за хв. Посилюються розлади зовнішнього дихання, відзначаються виражена блідість або мармуровість шкірних покривів, холодний піт, різке похолодання кінцівок, анурія, ступор, втрата свідомості. Істотними ознаками термінальної стадії шоку є підвищення показника гематокриту і зниження об'єму плазми.
Діагностика. Діагноз геморагічного шоку звичайно не викликає великих труднощів, особливо за наявності масивної кровотечі. Однак ранній діагностиці компенсованого шоку, при якій забезпечений успіх лікування, лікарі інколи не приділяють уваги через недооцінку наявних симптомів. Не можна оцінювати тяжкість шоку тільки за показниками АТ або кількістю вирахуваної крововтрати. Про адекватність гемодинаміки необхідно судити на основі комплексу досить простих симптомів і показників: 1) характеристики кольору і температури шкірних покривів, особливо кінцівок; 2) оцінка пульсу; 3) вимірювання АТ; 4) оцінка "шокового індексу"; 5) визначення погодинного діурезу; 6) вимірювання ЦВТ; 7) визначення показників гематокриту; 8) характеристики КОС крові.
За кольором і температурою шкірних покривів можна судити про периферичний кровотік. Тепла і рожева шкіра, рожевий колір нігтьового ложа навіть при знижених показниках АТ свідчать про добрий периферичний кровотік. Холодна бліда шкіра при нормальних і навіть дещо підвищених показниках АТ - про централізацію кровообігу і порушення периферичного кровотоку. Мармуровість шкірних покривів та акроціаноз вказують на глибоке порушення периферичного кровообігу і парез судин.
Частота пульсу є простим і важливим показником стану хворої тільки в зіставленні з іншими симптомами. Так, тахікардія може вказувати на гіповолемію та гостру серцеву недостатність. Диференціюють ці стани шляхом вимірювання ЦВТ. З таких позицій слід підходити і до оцінки АТ.
Простим і досить інформативним показником ступеня гіповолемії при геморагічному шоці є так званий шоковий індекс - відношення частоти пульсу за хвилину до величини систолічного артеріального тиску. У здорових людей він становить 0,5, при зниженні ОЦК на 20 - 30 % він збільшується до 1,0, при втраті 30 - 50 % ОЦК дорівнює 1,5. При шоковому індексі 1,0 стан хворої викликає серйозне занепокоєння, а при підвищенні його до 1,5 життя пацієнта знаходиться під загрозою.
Погодинний діурез є важливим показником, що характеризує органний кровотік. Зниження діурезу до 30 мл за годину свідчить про недостатність периферичного кровообігу, нижче 15 мл за годину - про наближення незворотності декомпенсованого шоку.
ЦВТ має істотне значення в комплексній оцінці стану хворої. За Г.А. Рябовим і ін. (1983) нормальні показники ЦВТ складають 50 - 120 мм вод. ст. Цифри ЦВТ можуть бути критерієм для вибору основного напрямку лікування. Рівень ЦВТ нижче 50 мм вод. ст. свідчить про наявність гіповолемії, що вимагає негайної компенсації. Якщо на фоні інфузійной терапії АТ продовжує залишатися низьким, то підвищення ЦВТ понад 140 мм вод. ст. вказує на декомпенсацію серцевої діяльності, що є показанням до кардинальної терапії. В цій же ситуації низькі показники ЦВТ передбачають збільшення об'єму швидкості інфузії.
Показник гематокриту в поєднанні з вищезазначеними даними є інформативним тестом, що свідчить про адекватність або неадекватність кровообігу. Гематокрит у жінок складає 43 % (0,43 л/л). Зниження гематокритного показника нижче 30 % (0,30 л/л) є загрозливим симптомом, нижче 25 % (0,25 л/л) - характеризує важкий ступінь крововтрати. Підвищення гематокриту в ІІІ стадії шоку вказує на незворотність його перебігу.
Таблиця 1.
Визначення величини крововтрати за лабораторними даними
| Вміст гемоглобіну | 108-103 | 102-88 | 87-80 | < 80 |
| Гематокрит | 0,44-0,40 | 0,38-0,32 | 0,31-0,23 | < 0,23 |
| Величина крововтрати, л | 0,5 | 1,0 | 1,5 | >2,0 |
| Дефіцит ОЦК, % | 10 | 20 | 30 | >40 |
Лікування.
Для забезпечення успіху терапії необхідно керуватися таким правилом: лікування потрібно розпочати якомога раніше, воно повинно бути комплексним, проводитися з урахуванням причини кровотечі і преморбідного стану. Комплекс лікувальних заходів включає в себе:
- Гінекологічна допомога і операції, спрямовані на зупинку кровотечі.
- Надання анестезіологічної допомоги.
- Безпосереднє виведення зі стану шоку.
Їх слід проводити паралельно, чітко і швидко.
Необхідне адекватне знеболювання. Обсяг оперативного втручання повинен забезпечити надійний гемостаз. Якщо для зупинки кровотечі потрібно видалити матку, це слід зробити якомога швидше. Вагання щодо можливості збереження менструального циклу або репродуктивної функції у молодих жінок не повинні гальмувати дій лікаря. З іншого боку, при важкому стані хворої не варто без показань розширювати обсяг операції, оскільки це може погіршити прогноз. При загрозливому стані хворої оперативне втручання проводять в три етапи: 1) лапаротомія, зупинка кровотечі; 2) реанімаційні заходи; 3) продовження операції.
Після завершення оперативного втручання продовжують надавати анестезіологічну допомогу і ШВЛ, що є найважливішими компонентами в тривалій комплексній терапії шоку.
Одним із основних засобів лікування геморагічного шоку є інфузійно-трансфузійна терапія, спрямована на:
- Відновлення ОЦК і ліквідацію гіповолемії.
- Підвищення кисневої ємності крові.
- Нормалізацію реологічних властивостей крові і ліквідацію порушень мікроциркуляції.
- Біохімічну і колоїдно-осмотичну корекцію крові.
- Усунення гострих порушень згортання крові.
Для успішного проведення інфузійно-трансфузійної терапії з метою відновлення ОЦК і перфузії тканин важливо враховувати кількісне співвідношення середовищ, об'ємну швидкість і тривалість вливання.
Питання про кількість інфузійних середників, необхідних для виведення хворої зі стану геморагічного шоку, є непростим. Орієнтовно його вирішують на основі оцінки вирахуваної крововтрати і даних клінічного обстеження. Зважаючи на депонування крові при шоці, обсяг рідини, що вливається, повинен перевищувати об'єм передбачуваної крововтрати: при втраті 1000 мл крові - в 1,5 рази, 1500 мл - в 2 рази, при більш масивній крововтраті - в 2,5 раза. Чим раніше починається відновлення крововтрати, тим меншою кількістю рідини вдається досягнути стабілізації стану. Звичайно ефект від лікування є більш сприятливим, якщо в перші 1-2 години заповнюється приблизно 70 % втраченого обсягу.
Про необхідну кількість введених середників можна судити в процесі проведення терапії на основі оцінки стану центрального і периферичного кровообігу. Достатньо простими та інформативними критеріями є, як вже вказувалося, забарвлення і температура шкірних покривів, пульс, АТ, шоковий індекс, ЦВТ і погодинний діурез.
Вибір інфузійних засобів залежить від багатьох факторів: від вихідного стану хворої, причини геморагії, головним чином, від обсягу крововтрати і патофізіологічної реакції організму хворої на неї. До складу обов'язково входять колоїдні, кристалоїдні розчини, консервована кров та її компоненти.
Враховуючи величезне значення фактору часу для успішного лікування геморагічного шоку, на початковому етапі терапії необхідно використати завжди наявні колоїдні розчини з достатньо високою осмотичною і онкотичною активністю. Таким препаратом є поліглюкін. Повертаючи рідину в кровоносне русло, ці розчини допомагають мобілізації компенсаторних можливостей організму і завдяки цьому дають час для підготовки до наступної гемотрансфузії, яку необхідно починати проводити якомога швидше з обов'язковим дотриманням умов, усіх правил та інструкцій.
Консервована кров та її компоненти (еритроцитарна маса) залишаються найважливішими інфузійними середниками при терапії геморагічного шоку, оскільки в нинішній час тільки з їхньою допомогою можна відновити порушену функцію транспортування кисню в організмі. Необхідно використати одногрупну консервовану кров, термін зберігання якої не перевищує 3 діб, підігріту до 37°С.
М.А. Рєпіна рекомендує компенсувати донорською кров'ю 60 % крововтрати. В.А. Климанский і Я.А. Рудаєв (1984) підкреслюють, що в процесі безперервного лікування не слід вливати більше 3000 мл крові через можливість розвитку синдрому масивної трансфузії або гомологічної крові.
Для дотримання умов режиму керованої гемодилюції гемотрансфузію необхідно проводити, вводячи колоїдні і кристалоїдні розчини в співвідношенні 1:1 або 1:2. З метою гемодилюції можна застосовувати будь-які розчини, що є в розпорядженні лікаря, використовуючи їхні якісні характеристики в бажаному напрямку. Кровозамінники покращують реологічні властивості крові, зменшують агрегацію формених елементів і завдяки цьому повертають депоновану кров в активний кругообіг, покращують периферичний кровотік. Такими властивостями найбільшою мірою володіють препарати, виготовлені на основі декстранів: поліглюкін і peoпoліглюкін. Зайва рідина видаляється з організму шляхом форсованого діурезу.
Адекватна терапія геморагічного шоку вимагає не тільки великої кількості інфузійних середників, але і значної швидкості їхнього введення, так званої об'ємної швидкості введення. При важкому геморагічному шоці об'ємна швидкість вливання повинна відповідати 250-500 мл/хв. II стадія шоку вимагає вливання зі швидкістю 100-200 мл/хв. Така швидкість може бути досягнута струминним введенням розчинів в декілька периферичних вен або катетеризацією центральних вен. Необхідно раціонально починати інфузію шляхом пункції ліктьової вени і відразу ж розпочати катетеризацію великої вени, частіше підключичної. Наявність катетера в великій вені робить можливим проведення інфузійно-трансфузійної терапії тривалий час.
Темп вливання рідини, співвідношення введеної крові і кровозамінників, елімінація надлишку рідини повинні проводитися під постійним контролем загального стану хворої (колір і температура шкірних покривів, пульс, АТ, погодинний діурез), на основі оцінки показників гематокриту, ЦВТ, КОС, ЕКГ. Тривалість інфузійної терапії повинна бути строго індивідуальною.
При стабілізації стану хворої, нормалізації шкірних покривів, відновленні рівня АТ (систолічного не нижче 90 мм рт. ст.), задовільному наповненні пульсу, зникненні задишки, погодинному діурезі не менше 30-50 мл без його форсування, збільшенні показника гематокриту до 30 % (0,3 л/л), можна переходити до крапельного введення крові і рідини в співвідношенні 2:1, 3:1. Крапельне введення розчинів повинно тривати добу і більше до повної стабілізації всіх показників гемодинаміки.
Метаболічний ацидоз, що супроводжує геморагічний шок, зазвичай коригують крапельним внутрішньовенним введенням 150-200 мл 4-5 % розчину натрію бікарбонату, у важких випадках - вливанням 500 мл 3,6 % розчину тригідрооксиметил - амінометану (трис-буфера). Точну кількість розчинів визначають залежно від показників дефіциту основ (-BE), за формулою:
BE = маса тіла / 2
Для покращання окисно-відновних процесів показане введення 200-300 мл 10 % розчину глюкози з адекватною кількістю інсуліну (на 4 г чистої речовини глюкози 1 ОД інсуліну), 100 мл кокарбоксилази, вітамінів групи В і С.
Після ліквідації гіповолемії на фоні покращання реологічних показників крові важливим компонентом нормалізації мікроциркуляції є застосування препаратів, що знімають периферичну вазоконстрикцію. Хороший ефект дасть введення 0,5 % розчину новокаїну в кількості 150-200 мл з 20 % розчином глюкози або іншими інфузійними середниками в співвідношенні 1 : 1 або 2 : 1. Констрикцію периферичних судин можна усунути введенням спазмолітичних препаратів (папаверину 2 % - 2 мл, но-шпи 2 % - 2-4 мл, еуфіліну 2,4 % - 10 мл) або гангліоблокаторів типу пентаміну (0,5-1 мл 0,5 % розчину крапельно з ізотонічним розчином натрію хлориду) і гексонію (1 мл 2,5 % розчину крапельно). Для покращення ниркового кровотоку показане введення 10 % розчину маніту в кількості 150-200 мл або сорбіту в кількості 400 мл. Для швидкого діуретичного ефекту розчин маніту вливають зі швидкістю 80-100 крапель за хвилину. Вводити всі зазначені засоби необхідно здійснювати під обов'язковим контролем АТ, ЦВТ і діурезу. При необхідності разом з осмодіуретиками призначають салуретики: 40-60 мг лазиксу.
Не слід забувати про введення антигістамінних препаратів (2 мл 1 % розчину димедролу, 2 мл 2,5 % розчину дипразину (піпольфену) чи 2 мл 2 % розчину супрастину), що не тільки проявляють позитивну дію на обмінні процеси, але і сприяють нормалізації мікроциркуляції. Важливим компонентом в лікувальних заходах є введення великих доз глюкокортикостероїдів, які покращують скорочувальну функцію міокарда і тонус периферичних судин. Разова доза гідрокортизону – 125-250 мг, преднізолону – 30-60 мг; добова доза гідрокортизону - 1,0-1,5 г. Кардіальні засоби включають в комплекс терапії шоку після достатнього відновнення ОЦК. Найчастіше застосовують 0,5-1,0 мл 0,5 % розчину строфантину або 1 мл 0,6 % розчину корглікону з 10-20 мл 40 % глюкози.
Порушення згортальної системи крові, що супроводжує розвиток геморагічного шоку, необхідно коригувати під контролем коагулограми, зважаючи на значну різноманітність цих порушень. Так, при І і ІІ стадіях шоку відзначається підвищення коагуляційних властивостей крові. При III (інколи II) може розвиватися коагулопатія споживання з різким зниженням вмісту прокоагулянтів і з вираженою активацією фібринолізу. Використання інфузійних розчинів, позбавлених факторів згортання і тромбоцитів, призводить до наростання втрати цих факторів, рівень яких вже знижений в результаті кровотечі. Таким чином, разом з коагулопатією споживання геморагічний шок ускладнюється коагулопатією дефіциту.
Крім того, на характер коагуляційних порушень впливає стан жінки перед розвитком кровотечі, а також вид акушерської патології, який призвів до геморагії. При розриві матки відзначається значна активація фібринолізу. Передчасне відшарування нормально розміщеної плаценти, що, як правило, розвивається на фоні пізнього гестозу, для якого характерна наявність хронічного синдрому ДВЗ, супроводжується вираженою гіперкоагуляцією з обструкцією периферичного кровообігу і слабким вираженням або навіть відсутністю активації фібринолітичної системи.
З урахуванням вищевказаного слід проводити відновлення згортальної спроможності крові шляхом введення прокоагулянтів, яких не вистачає, з "теплою" або "свіжоцитратною" кров'ю, сухою або нативною плазмою, антигемофільною плазмою, препаратами фибриногену або кріопреципітату. При необхідності нейтралізації тромбіну можна застосовувати антикоагулянт прямої дії - гепарин, для зниження фібринолізу - антифібринолітичні препарати контрикал або гордокс. Лікують синдром ДВЗ крові під контролем коагулограми.
Як відзначалося раніше, фактор часу при лікуванні геморагічного шоку часто стає вирішальним. Чим раніше розпочато лікування, тим менше зусиль і засобів вимагається для виведення хворої з шоку, тим кращий найближчий і віддалений прогноз. Так, для терапії компенсованого шоку достатньо відновити обсяг крові, провести профілактику гострої ниркової недостатності (ГНН), у деяких випадках - нормалізувати КОС. При лікуванні декомпенсованого незворотного шоку вимагається використати весь арсенал лікувальних заходів. При терапії ІІІ стадії шоку часто максимальні зусилля лікарів виявляються неуспішними.
Виведення хворої з критичного стану, пов'язаного з геморагічним шоком, є першим етапом лікування. В наступні дні триває терапія, спрямована на ліквідацію наслідків масивних кровотеч і профілактику нових ускладнень. Лікування в цей період направлене на підтримання функції нирок, печінки і серця, нормалізацію водно-сольового і білкового обміну, підвищення глобулярного обсягу крові, профілактику і лікування анемії, попередження інфекцій.
СИНДРОМ ДИСЕМІНОВАНОГО ВНУТРІШНЬОСУДИННОГО ЗГОРТАННЯ КРОВІ
Синдром дисемінованого внутрішньосудинного згортання крові в гінекологічній практиці найчастіше зустрічається при геморагічному шоці, викликаному при сепсисі, у жінок з захворюваннями серцево-судинної системи, нирок і печінки, переливанні несумісної крові.
Патогенез. Пусковим механізмом в розвитку синдрома ДВЗ крові є активація кров'яного або тканинного тромбопластину за рахунок гіпоксії i метаболічного ацидозу будь-якого джерела, травми, надходження в кровоносне русло отрути різного генезу і т.д. Утворення активного тромбопластину - перша і найтриваліша фаза гемостазу, в якій беруть участь багато факторів згортання, як плазмових (XII, XI, IX, VIII, X, IV, V), так і тромбоцитарних (ІІІ, І). Під впливом активного тромбопластину за участю іонів кальцію (фактор IV) протромбін переходить в тромбін (II фаза). В присутності іонів кальцію і за участю фактору тромбоцитів ІV тромбін переводить фібриноген в фібрин-мономер, який, в свою чергу, під впливом XIII фактору плазми і тромбоцитарного фактору ІІ перетворюється в нерозчинні нитки фібрину-полімеру (III фаза).
Окрім змін в прокоагулянтній ланці гемостазу, відбувається активація тромбоцитарної ланки, що призводить до адгезії і агрегації тромбоцитів з виділенням біологічно активних речовин: кінінів, простагландинів, гістаміну, катехоламінів і т.д. Дані речовини змінюють судинну проникність, викликають спазм судин, відкриття артеріовенозних шунтів, сповільнюють кровотік в системі мікроциркуляції, сприяють стазу, розвитку сладж-синдрому, депонуванню і секвестрації крові, утворенню тромбів. В результаті цих процесів відбувається порушення кровопостачання тканин і органів, в тому числі життєво важливих: печінки, нирок, легень, деяких відділів мозку.
У відповідь на активацію системи згортання включаються захисні механізми, спрямовані на відновлення порушеної регіонарної тканинної перфузії: фібринолітична система і клітини ретикулоендотеліальної системи. Таким чином, на фоні дисемінованого внутрішньосудинного згортання крові внаслідок підвищеного споживання прокоагулянтів і підсилення фібринолізу розвивається підвищена кровоточивість, формується тромбогеморагічний синдром.
Клінічна картина: Синдром ДВЗ перебігає у вигляді послідовних фаз. М.С. Мачабелі виділяє чотири стадії цього захворювання:
І стадія - гіперкоагуляція, пов'язана з появою великої кількості активного тромбопластину.
II стадія - коагулопатія споживання, пов'язана зі зменшенням вмісту прокоагулянтів через включення їх в мікротромби. Водночас активізується фібриноліз.
ІІІ стадія - різке зниження вмісту в крові всіх прокоагулянтів аж до розвитку афібриногенемії на фоні вираженого фібринолізу. Ця стадія характеризується особливо важкими геморагіями. Якщо хвора не гине, то синдром ДВЗ крові переходить в наступну стадію.
IV стадія - відновна, при якій відбувається поступова нормалізація стану системи, що згортає кров. Інколи на цій стадії можуть виявлятися результати тромбозів і порушення регіонарної перфузії органів і тканин у вигляді гострої ниркової недостатності (ГНН), гострої дихальної недостатності (ГДН) і/або порушення мозгового кровообігу.
Слід підкреслити, що в клінічній практиці у хворих синдром ДВЗ нечасто проявляється в такій класичній формі. Залежно від причини, яка викликала його розвиток, тривалості патогенного впливу, попереднього стану здоров'я жінки одна зі стадій може бути тривалою і не переходити в іншу. В одних випадках має місце домінування гіперкоагуляції на фоні нерізко вираженого фібринолізу, в інших - фібриноліз є провідною ланкою патологічного процесу.
З.Д. Федорова розробила більш досконалу класифікацію фаз, або стадій, перебігу сидрому ДВЗ,яка задовольнить практичних лікарів. Згідно з нею, виділяють: 1) стадію гіперкоагуляції; 2) стадію гіпокоагуляції без генералізованої активації фібринолізу; 3) стадію гіпокоагуляції з генералізованою активацією фібринолізу; 4) стадію повного незгортання крові. В фазу гіперкоагуляції час згортання загальних тестів коагулограми скорочений, фібринолітична і антикоагулянтна активність знижена. В другу фазу коагулограма вказує на споживання факторів згортання, знижену кількість тромбоцитів, протромбіновий індекс, активність факторів системи згортання крові (V, VII, VIII). Підвищення рівня вільного гепарину і поява продуктів деградації фібрину (ПДФ) свідчать про локальну активацію фібринолізу. ІІІ фаза характеризується зменшенням кількості тромбоцитів, зниженням концентрації і активності прокоагулянтів з одночасним генералізованим підвищенням фібринолітичної активності і наростанням вмісту вільного гепарину. Фазі повного незгортання крові притаманний крайній ступінь гіпокоагуляції з надзвичайно високою фібринолітичною і антикоагулянтною активністю.
Клінічні ознаки при гострому перебігу синдрому ДВЗ крові зумовлені тромботичними і геморагічними порушеннями різного ступеня вираження, що маніфестують: 1) крововиливами в шкіру, cлизові оболонки, з місця ін'єкцій, травм, операційних ран, матки; 2) некрозами деяких ділянок шкіри і слизових оболонок; 3) проявами з боку ЦНС у вигляді ейфорії, дезорієнтації, затьмарення свідомості; 4) гострою нирковою, печінковою і легеневою недостатністю. Ступінь вираження клінічних проявів залежить від стадії ДВЗ синдрому. При цьому слід пам'ятати, що причинні фактори, які викликали розвиток ДВЗ синдрому, багато в чому визначають характер згортальних порушень і антизгортальних систем.
Діагностика. Клінічна діагностика синдрому ДВЗ тяжка, з одного боку, бо всі симптоми не є специфічними для даної патології, з іншого - тому, що надзвичайно різноманітна симптоматика основних захворювань і станів, на фоні яких він розвивається. Тому на перший план в діагностиці гострого синдрома ДВЗ крові виступають лабораторні дослідження системи гемостазу.
Для гострої форми ДВЗ характерні подовження часу згортання крові (понад 10 хв), зниження кількості тромбоцитів і рівня фібриногену, збільшення часу рекальцифікації плазми, протромбінового і тромбінового часу, підвищення концентрації продуктів деградації фібрину (ПДФ) і розчинних комплексів мономерів фібрин-фібриногену (РКМФ) (Макацарея А.Л., 1983).
З.Д. Федорова (1986) для встановлення фази перебігу синдрому ДВЗ пропонує такі тести експрес-діагностики: час згортання крові, спонтанний лізис згустка, тромбін-тест, визначення ПДФ етаноловим методом і імунопреципітацією, кількість тромбоцитів, протромбіновий час, тест фрагментації еритроцитів. Для І фази характерні скорочення часу згортання крові і протромбінового часу, позитивний етаноловий тест. В II фазу при ДВЗ синдромі відбувається помірне зменшення кількості тромбоцитів (120 на 109/л), тромбіновий час подовжується до 60 с і більше, визначаються ПДФ і пошкоджені еритроцити. В III фазу відбуваються подовження часу згортання крові, тест-тромбіну і тромбінового часу, швидкий лізис утвореного згустка крові, зменшується кількість тромбоцитів до 100 на 109/л. Для IV фази характерні такі показники: згусток не утворюється, тромбін-тест - більше 60 с, кількість тромбоцитів - менше 60 на 109/л.
Хронічна форма ДВЗ характеризується нормальною або зменшеною кількістю тромбоцитів, нормальною або навіть підвищеною кількістю фібриногену, нормальними або дещо зниженими показниками протромбінового часу, зменшенням часу згортання крові, збільшенням кількості ретикулоцитів. Важливого діагностичного значення ДВЗ синдрому набуває поява ПДФ і РКМФ.
ЛІКУВАННЯ. Терапія ДВЗ синдрому повинна бути строго індивідуальною, спрямованою на: 1) ліквідацію основних причин, які викликали його; 2) нормалізацію гемодинаміки; 3) нормалізацію згортання крові.
При хронічних формах ДВЗ у вагітних з пізніми гестозами в комплекс лікувальних заходів включають низькомолекулярні кровозамінники (реополіглюкін, неогемодез, полідез, желатиноль) в поєднанні зі спазмолітичними речовинами. Цим досягається покращання реологічних властивостей крові, що перешкоджають мікротромбозу і сприятливої оптимізації тканинної перфузії. Важливим засобом лікування цієї форми ДВЗ є гепарин, який вводять підшкірно по 5000-10000 ОД кожних 12 годин до нормалізації рівня тромбоцитів і фібриногену. Гепарин є антикоагулянтом прямої дії, він зменшує адгезивність тромбоцитів, володіє антитромбопластиновою і антитромбіновою активністю, завдяки чому нормалізує кровообіг в паренхіматозних органах.
Гострі форми ДВЗ синдрому, як правило, поєднуються з геморагічним шоком, тому заходи щодо відновлення центральної і периферичної гемодинаміки при них мають багато спільного. Для інфузійно-трансфузійної терапії в таких випадках віддають перевагу цільній "теплій" або "свіжоцитратній" крові, а не її компонентам. Режим, що керується гемодилюцією, здійснюється в межах, які не перевищують 15-25 % ОЦК, за рахунок желатинолю, альбуміну, реополіглюкіну і кристалоїдів типу розчину Рінгера: лактату натрію, лактосолу.
Найскладнішим при лікуванні гострої форми ДВЗ синдрому є відновлення нормальних коагуляційних властивостей крові, для чого необхідно припинити внутрішньосудинне згортання, знизити фібринолітичну активність і відновити коагуляційний потенціал крові. Це завдання повинен виконувати фахівець-гематолог під контролем коагулограми. На відміну від хронічної форми ДВЗ синдрому, при гострій формі геморагія є не тільки наслідком підвищеного споживання прокоагулянтів, але і їхньою втратою, порушенням синтезу і гемодилюцією. Тому для успіху терапії необхідна попередня ліквідація основної причини кровотечі, тобто вилучення матки, а також точна лабораторна діагностика дефекту згортання.
Гепарин вводять внутрішньовенно на 100-150 мл ізотонічного розчину натрію хлориду або 5 % розчину глюкози зі швидкістю 30-50 крапель за хвилину. Його дозують залежно від фази ДВЗ синдрому: в І фазу допускається вводити до 5000 ОД (70 ОД/кг), в II і III фази – 2500-3000 ОД (30-50 ОД/кг), а в IV фазу гепарин вводити не можна (Баришев Б.А., 1981; Репина М.А. і Федорова 3.А., 1986). При передозуванні гепарину використовують протаміну сульфат: 100 ОД гепарину нейтралізують 0,1 мл 1 % розчину протаміну сульфату. Не рекомендується застосовувати гепарин при обширних раневих поверхнях.
Гальмування фібринолітичної активності можна здійснити за допомогою інгібіторів протеолізу типу контрикалу, трасилолу, гордоксу. Разова доза контрикалу - 20000 ОД (добова - 60000 ОД), трасилолу - 25000 ОД (100000 ОД), гордоксу - 100000 ОД (5000000 ОД). Не рекомендується вводити внутрішньовенно синтетичні інгібітори протеолізу (епсилон-амінокапронова кислота, памба), тому що вони викликають стабілізацію судин в системі мікроциркуляції і призводять до важких порушень кровообігу в нирках, печінці, мозку. Ці препарати можна застосовувати тільки місцево (Репина М.А., Федорова З.А, 1986). Інгібітори фібринолізу використовують за суворими показаннями, бо різке зниження фібринолітичної активності може спричинити підсилення внутрішньосудинного відкладання фібрину з наступним некрозом коркового шару нирок, печінки та інших органів. Найкращий ефект дає введення цих препаратів в III і IV фази ДВЗ синдрому.
Найкращим засобом відновлення коагуляційних властивостей крові при гострій формі ДВЗ синдрому є замісна терапія. З цією метою використовують "теплу" донорську і свіжоцитратну кров, суху, нативну та антигемофільну плазму, кріопреципітат. Кров переливають в початкових дозах до 500 мл. Після оцінки ефекту гемотрасфузії вливання крові повторюють. Суху, нативну і/або антигемофільну плазму застосовують в загальній кількості 250-500 мл.
Ліквідація гострих проявів синдрому ДВЗ не означає закінчення інтенсивної терапії. В період реабілітації необхідно продовжувати лікування, спрямоване на ліквідацію можливих проявів ниркової та печінкової недостатності, корекцію дихальних порушень, відновлення білкового та електролітного гомеостазу, профілактику інфекційних ускладнень. Важливо строго контролювати стан антизгортальної системи крові.
Сучасні принципи застосування гемотрансфузій і кровозамінних розчинів
Для виведення хворих з критичних станів, пов'язаних з гіповолемією і порушенням тканинної перфузії, використовують велику кількість різноманітних інфузійних засобів, спрямованих на відновлення порушених механізмів кровообігу і тканинного обміну. Щоб застосовувати їх з максимальним ефектом, практичний лікар повинен володіти інформацією про якісну характеристику найважливіших інфузійних середників, про необхідний обсяг вливання в різних ситуаціях і раціональне співвідношення препаратів, які вводяться.
Характеристика основних інфузійних середників. На сьогодні консервовану донорську кров не вважають єдиним або основним засобом лікування критичного стану в гінекологічній практиці, однак як сама кров, так і її компоненти посідають певне місце в комплексі інфузійної терапії екстремальних станів. Гемотрансфузія сприяє відновленню кількості еритроцитів, що є єдиним засобом транспортування кисню. Проблема створення кровозамінників, які переносять до тканин кисень і вилучають вуглекислоту, поки що перебуває на етапі експериментальних досліджень.
Донорська кров є також єдиним середовищем, що містить повноцінні білки плазми.
Гемотрансфузія - надзвичайно відповідальна операція, яку необхідно проводити за суворими показаннями і з дотриманням усіх правил та інструкцій, бо консервація і, особливо, тривалі терміни зберігання донорської крові призводять до того, що кров втрачає деякі позитивні властивості і набуває небажаних якостей. Вже в перші дні зберігання руйнуються вітаміни і гормони. За рахунок руйнування прокоагулянтів і підвищення фібринолітичної активності знижується коагуляційна спроможність крові. Внаслідок втрати фосфорорганічних сполук, що призводить до підвищення спорідненості гемоглобіну до кисню і ускладнення його віддачі, зменшується спроможність еритроцитів переносити кисень.
При зберіганні консервованої крові, відбувається зниження рН (до 10-го дня до 6,0) і збільшення вмісту калію (до 10-го дня до 8 ммоль/л). Необхідність збереження крові при температурі +9 °С вимагає її підігріву до 37 оС перед трансфузією. В іншому випадку організм реципієнта змушений витрачати надто відчутні енергетичні ресурси. Переливання більших кількостей холодної крові може npизвести до небезпечної для міокарду гіпотермії.
При гемотрансфузії залишається актуальним ризик зараження інфекційними захворюваннями, в тому числі гепатитами, сифілісом, малярією, СНІДом.
Незважаючи на сумісність крові донора і реципієнта за системами АВО і Rh-Hr, не виключається можливість розвитку гемотрансфузійних реакцій за іншими факторами еритроцитів, а також лейкоцитів і тромбоцитів.
При переливанні великої кількості крові (понад 2500-3000 мл за добу) можуть розвиватися ускладнення, описані в літературі як синдром гомологічної крові, що найбільш небезпечний для життя хворої. Ці ускладнення зумовлені негативними властивостями засобів консервації і зберігання крові, а також імунобіологічними факторами. Вплив низької температури крові, що консервувалася, в більшій кількості; зниження рН; гіперкаліємії; гіпокальціємії, внаслідок цитратної інтоксикації; агрегації формених елементів, мікротромбозу і секвестрації крові, пов'язаних з імунологічною несумісністю донорів і реципієнтів, що призводять до гіповолемії, зумовлюють розвиток стійкої артеріальної гіпотонії, аритмії, тахікардії, фібриляції шлуночків і зупинку серця. Окрім порушень діяльності серцево-судинної системи, симптомокомплекс синдрому масивних гемотрансфузій і гомологічної крові складається з проявів печінкової, ниркової, легеневої недостатності і порушень згортальної і протизгортальної систем крові.
Все сказане ускладнює і робить небезпечним гемотрансфузії, особливо проведені в більшій кількості. Однак при геморагічному шоці позитивні якості крові роблять її необхідним трансфузійним середовищем. Дію негативних властивостей крові потрібно звести до мінімуму шляхом дотримання таких правил:
- Переливати кров, одногрупну за системами АВО і Rh-фактору.
- Для виведення жінок з критичного стану використовувати кров або її компоненти не пізніше 3-ї доби зберігання.
- Підігрівати кров до 37 оС.
- На кожних 500 мл консервованої крові вводити 10 мл 10 % розчину кальцію хлориду, 25 мл 4 % розчину натрію бікарбонату, 2 мл 1 % розчину вікасолу, 5 мл 5 % розчину аскорбінової кислоти, 100 мл 20 % розчину глюкози і 5 ОД інсуліну.
- Трансфузію крові поєднувати з вливанням кровозамінників в режимі керованої гемодилюції, яка не перевищує 30 % ОЦК.
В трансфузіології, окрім консервованої крові, застосовують "свіжоцитратну" і нестабілізовану ("теплу") кров донора. Така кров зберігає всі основні біологічні властивості крові, тому трансфузія свіжоцитратної або "теплої" крові незамінна при коагулопатичних і септичних станах. Однак широке використання такої крові обмежується ризиком передачі інфекції від донора реципієнту, а також організаційними труднощами, пов'язаними з необхідністю тримати напоготові велику кількість донорів.
Компоненти і препарати крові. Еритроцитарна маса є основним компонентом цільної крові, що залишається після відділення плазми. Порівняно зі звичайною консервованою кров'ю, містить в 1,5-2,0 рази більше еритроцитів; гематокрит еритроцитарної маси складає 0,60-0,70 л/л. Трансфузія еритроцитарної маси краща, ніж цільної донорської крові, оскільки при цьому зменшується кількість ускладнень, зумовлених імунологічними причинами.
При виведенні хворої з критичного стану еритроцитарну масу рекомендується розводити реологічно активними плазмозамінниками (наприклад, реополіглюкіном) у співвідношенні 1:2 або 1:3.
Еритроцитарна суспензія являє собою еритроцитарну масу, повністю звільнену від плазми і зважену в желатинолі, реополіглюкіні або глюкозі з цитратом натрію. Еритроцитарна суспензія ефективна для лікування геморагічного шоку, і значно знижує частоти посттрансфузійних ускладнень.
Перспективним є використання заморожених еритроцитів. Кріоконсервування зберігає фізіологічні властивості еритроцитів. Переливання навіть великої кількості заморожених еритроцитів не призводить до розвитку синдромів гомологічної крові або масивних гемотрансфузій. Значно знижується небезпека зараження вірусним гепатитом В.
Плазма - другий компонент крові, до складу якого входять 90 % води, 8 % білків, 2 % органічних і неорганічних речовин. Плазма містить біологічно активні речовини.
Нативну плазму застосовують при патологічних станах, що супроводжуються гіпо- і диспротеїнемією, інтоксикацією, гіповолемією, коагулопатіями. Добова доза складає 250-750 мл.
Суха ліофілізорована плазма має всі властивості нативної плазми. Концентровані розчини сухої плазми містять велику кількість прокоагулянтів, тому можуть використовуватися при гострих порушеннях згортання крові. Добова доза становить від 250 до 750 мл.
Тромбоцитарна маса - третій компонент крові, що являє собою суспензію тромбоцитів у плазмі. Застосовується для зупинки кровотечі, пов'язаної з тромбоцитопенією.
З донорської крові виготовляють такі препарати, як альбумін, протеїн і еригем.
Розчин альбуміну має високу колоїдно-осмотичну активність, завдяки чому сприяє переміщенню рідини з інтерстиціального у внутрішньосудинний простір. Альбумін тривалий час втримується у кровоносному руслі і є цінним енергетичним запасом для організму. Ці позитивні властивості альбуміну зумовлюють найбільш часте його використання. 5 %, 10 % і 20 % розчини альбуміну застосовують для ліквідації гострої та хронічної гіповолемії, корекції гіпо- і диспротеїнемії, для детоксикації в кількості 200-400 мл.
Протеїн являє собою 4,3-4,8 % розчин білків донорської крові, в яких альбуміну 80-85 %, А- і В-глобулінів 15-20 %. За своєю колоїдно-осмотичною активністю протеїн близький до нативної плазми і застосовується для ліквідації гіповолемії в кількості 250-500 мл.
Еригем - 3 % розчин гемоглобіну в 5 % розчині глюкози; його готують з гемолізованих еритроцитів. Еригем належить до плазмозамінників гемодинамічної дії, тому його використовують при значних крововтратах. Середня доза 250-500 мл.
В розпорядженні практичного лікаря знаходиться великий арсенал кровозамінників, що поділяють на колоїдні і кристалоїдні розчини.
До колоїдних розчинів відносять похідні декстрану. Вітчизняним препаратом цього ряду є низькомолекулярний реополіглюкін. Він - цінний замінник плазми, що швидко підвищує ОЦК, покращує реологічні властивості крові, ліквідує стаз і агрегацію формених елементів крові, покращує периферичний кровотік і призводить до редепонування крові. Середня добова доза реополіглюкіну – 500-1000 мл.
До похідних декстрану належать також рондекс, реополіглюкін з глюкозою, реоглюман, поліфер.
Рондекс - 6 % розчин середньомолекулярного декстрану в ізотонічному розчині натрію хлориду. Добре відновлює ОЦК. Показання до застосування ті ж, що у поліглюкіну.
Реополіглюкін з глюкозою являє собою 10 % розчин низькомолекулярного декстрану з глюкозою. Препарат зменшує в'язкість крові, покращує її реологічні властивості, сприяє відновленню мікроциркуляції, попереджує агрегацію формених елементів. Середня доза 400-800 мл. Слід пам'ятати, що 100 мл кровозамінника містять 5 г глюкози, тому при введенні великої кількості препарату необхідно додавати адекватні дози інсуліну.
Реоглюман - 10 % розчин декстрану з додаванням 5 % маніту в ізотонічному розчині натрію хлориду. Кровозамінник має поліфункціональну дію: зменшує в'язкість крові, сприяє відновленню мікроциркуляції, попереджує і ліквідовує агрегацію формених елементів крові, володіє детоксикаційними, діуретичними і гемодинамічними властивостями. Препарат не слід вводити при надмірній гемодилюції (показник гематокриту менше 0,25 г/л), тромбоцитопенії, порушенні фільтраційної функції нирок. Реоглюман вводять внутрішньовенно крапельно, його середня доза - 400 мл, максимальна - 800 мл.
Поліфер - кровозамінник поліфункціональної дії: при його введенні поряд із збільшенням ОЦК відбувається стимуляція гемопоезу. Середня разова доза - 400 мл, добова - 1200 мл. Поліфер виводиться з організму в основному через нирки.
Синтетичними колоїдними плазмозамінниками є похідні полівінілпіролідону. В нашій країні випускають високоефективний препарат – неогемодез, який має низьку молекулярну масу, легко і швидко виводиться нирками, володіє реологічними і детоксикаційними властивостями, сприяє елімінації метаболічного ацидозу. Ці якості неогемодезу використовують при лікуванні інфекційних захворювань і септичного шоку. Одномоментно можна вводити 300-450 мл розчину, через 12 год інфузію повторюють.
В терапії критичних станів у гінекологічній практиці застосовують полідез - 3 % розчин полівінілового низькомолекулярного спирту в ізотонічному розчині натрію хлориду. Володіє вираженою детоксикаційною дією. Його вводять внутрішньовенно крапельно. Разова доза - до 400 мл.
Желатиноль (похідна желатину) володіє короткочасним ефектом гемодилюції, знижує в'язкість крові, легко елімінується нирками і проявляє детоксикаційну дію. Широко використовується в ургентній практиці для лікування шоку і в комплексній терапії інфекції. Середня доза – 500-1000 мл.
З кристалоїдних розчинів клінічне застосування знаходять ізотонічний розчин натрію хлориду, розчини Рінгера, Рінгера-Локка, лактатний розчин Рінгера (Рінгер-лактат), лактосол, гельвісол. Вони є необхідним компонентом в терапії геморагічного шоку. Тільки ці розчини можуть ліквідувати дефіцит позаклітинної рідини, зумовлений її переміщенням внаслідок як патофізіологічних процесів при розвитку шоку, так і терапевтичного застосування осмотично і онкотично активних засобів. Кристалоїдні розчини здатні змішатися з кров'ю в будь-якій кількості, зменшуючи її в'язкість і сприяючи збільшенню швидкості кровотоку. Крім того, Рінгер-лактат і лактосол дозволяють коригувати метаболічний ацидоз. Кристалоїдні розчини з успіхом застосовують в комплексі з колоїдними засобами, консервованою кров'ю і еритроцитарною масою.
Широкий вибір інфузійних засобів, знання їхніх характеристик дають можливість індивідуалізувати використання і здійснювати раціональне поєднання препаратів у кожному конкретному випадку.
ТРАВМАТИЧНІ УШКОДЖЕННЯ СТАТЕВИХ ОРГАНІВ
Пошкодження зовнішніх статевих органів і піхви
Пошкодження зовнішніх статевих органів і піхви можуть виникнути під час пологів, при грубих статевих зносинах, особливо в стані алкогольного сп”яніння, при згвалтуванні неповнолітніх. Зловмисний травматизм, виробничі травми, термічні та хімічні опіки зустрічаються досить рідко. Пошкодження медичного характеру можливі внаслідок променевої терапії при злоякісних новоутвореннях, а також при необережному обстеженні дзеркалами жінок, які не живуть статевим життям, та осіб старечого віку.
Провідними ознаками пошкоджень зовнішніх геніталій та піхви є біль і кровотеча. При травмах сечового міхура, прямої кишки та її сфінктера може спостерігатися нетримання сечі, газів і калу. Внаслідок значної васкуляризації ділянки вульви закриті пошкодження супроводжуються набряком та розвитком гематоми, при відкритих травмах – кровотечею, іноді досить значною. Утворення гематоми у вигляді багряного утвору, що швидко росте, проявляється болем, відчуттям напруження в ділянці статевих органів, тенезмами, іноді анемізацією. Масивні пошкодження піхви призводять до порушення цілості уретри, сечового міхура, прямої кишки та навколишньої клітковини. Надалі у таких хворих виникають кишково-піхвові або сечостатеві нориці.
Діагностика. Виявлення травм зовнішніх геніталій та піхви, як правило, не викликає труднощів. Діагностика грунтується на даних анамнезу, огляду, піхвового та прямокишкового досліджень. При підозрі на пошкодження, що проникають в черевну порожнину, ушкодження сечового міхура виконують цистоскопію, лапароскопію або діагностичну лапаротомію.
Лікування. Якщо травми не глибокі не проникають в черевну порожнину або суміжні органи, лікування обмежується місцевим застосуванням антисептиків. Важкі травми потребують оперативного втручання. При значній кровотечі необхідно терміново забезпечити гемостаз і відновити крововтрату, іноді потрібно провести протишокові заходи. Внаслідок можливого інфікування слід ввести протиправцеву, а при забрудненні рани – протигангренозну сироватку. Призначають антибіотики широкого спектра дії. Первинну обробку рани проводять за загальними хірургічними принципами. При чистій свіжій рані в ділянці промежини накладають вузлові кетгутові шви на слизову оболонку піхви та шовкові шви на шкіру. Якщо рана знаходиться біля уретри, зашивання проводять після введення в сечовипускальний канал металічного катетера, який після зашивання замінюють еластичним, залишивши його в сечовому міхурі з метою профілактики рефлекторної затримки сечовипускання. При кровотечі з рани в ділянці цибулин присінка піхви лігатури підводять до самої надкісниці для попередження травмування венозного сплетення. Якщо діагостовано незначну паренхіматозну кровотечу, обмежуються тугою тампонадою ділянки, яка кровоточить, і накладанням стискальної пов'язки. При утворенні гематоми, яка не збільшується, можна накласти стискальну пов'язку, призначити кровозупинні засоби: хлорид кальцію, вікасол, дицинон, вітаміни РР, С. Якщо гематома збільшується або інфікована, її необхідно розрізати, а судини, які кровоточать, прошити. При розриві промежини, який супроводжується травмою прямої кишки і забрудненням рани каловими масами, особливо через 12 годин і більше після травми, рану і пряму кишку промивають антисептичними розчинами: (0,05 % хлоргекседин біглюконатом, 5 % калій перманганатом, риванолом, фурациліном (1:5000)), тампонують тампоном, змоченим розчином фурациліну. Хворій призначають рідку дієту, антибіотики широкого спектру дії з урахуванням можливості анаеробної інфекції, детоксикаційні, знеболюючі засоби. Через кілька днів використовують тампони з маззю Вишневського, на 6 – 7 добу дають послаблюючі, на 10-11 добу дозволяють ходити, а через 2,5-3,0 місяці виконують оперативне втручання, об'єм якого визначається особливістю травми.
Пошкодження шийки і тіла матки
Пошкодження шийки і тіла матки найчастіше зустрічаються в акушерській практиці: під час пологів, при виконанні акушерських операцій, внутріматкових маніпуляцій і т.д. У гінекологічних хворих ці травми пов'язані з діагностичними вишкрібаннями слизової оболонки матки та гістероскопією, оскільки при цих маніпуляціях проводиться попереднє розширення цервікального каналу. Під час виконання кримінальних абортів досить часто виникають пошкодження внутрішніх статевих органів.
Перфорацію матки можна здійснити матковим зондом, розширювачем Гегара, кюреткою, наконечником вакуум-екскохлеатора. Цьому сприяють неправильні положення плода (ретрофлексія, гіперантефлексія, латеропозиція), патологічні зміни в стінці матки внаслідок деструктивних процесів, зумовлених розростанням і розпадом пухлини.
Ступінь травматизації матки при її перфорації може бути різним: без пошкодження периметрію, з пошкодженням периметрію з проникненням в черевну порожнину, з пошкодженням органів черевної порожнини – кишечника, сечового міхура, сальника. Перфораційний отвір може локалізуватися в дні матки, на передній і задній стінках, ділянці перешийка, по ребру матки, зокрема в зоні судинного пучка, в який входять маткова артерія та маткові вени.
Клініка. Прояви перфорації матки визначаються локалізацією, ступенем пошкодження і порушенням цілості суміжніх органів. Перфорація матки матковим зондом без травми очеревини і при відсутності кровотечі може перебігати безсимптомно. Перфорація матки в ділянці судинного пучка супроводжується клінікою важкої внутрішньої або зовнішньої кровотечі. При пошкодженні очеревини виникає різка больова реакція з розвитком шоку.
Важливими симптомами перфорації матки є проникнення інструмента (зонда, розширювача, кюретки) на глибину, що значно перевищує довжину порожнини матки, вилучення з перфоративного отвору сальника, петель кишечника, різка зміна стану хворої (сильний біль, явища шоку і внутрішньої кровотечі). При пошкодженні судин із збереженням очеревинного покриву може утворитися гематома між листками широкої зв'язки матки. Гематома визначається при пальпації живота, особливо чітко - при бімануальному обстеженні (болючий утвір еластичної консистенції з нечіткими контурами). Для уточнення наявності проникнення в черевну порожнину проводять лапароскопію і кульдоскопію.
При перфорації матки або підозрі на це ускладення необхідно негайно припинити всі подальші маніпуляції. Якщо перфорація виконана матковим зондом або невеликим розширювачем, хворій призначають ліжковий режим, кладуть лід на низ живота і ретельно стежать за появою кровотечі із статевих шляхів, регулярно вимірюють артеріальний тиск, частоту пульсу, температуру, визначають наявність чи відсутність симптомів подразнення очеревини в динаміці. Проводять дослідження клінічного аналізу крові, сечі, слідкують за діурезом. Протипоказано застосовувати наркотичні та знеболюючі середники, оскільки вони маскують початкову картину перитоніту. При відсутності ознак запалення очеревини і внутрішньої кровотечі продовжують консервативне лікування, яке включає детоксикаційну терапію (внутрішньовенну крапельну інфузію поліглюкіну, реополіглюкіну, неогемодезу, поліферу та інших кровозамінників), антибактеріальну терапію, введення утеротонічних засобів (окситоцин, ергометрин, метилергометрин, гіфотоцин). Якщо виникають тахікардія, підвищення температури тіла, з'являються навіть незначні ознаки пельвіоперитоніту, хворій показана пункція заднього склепіння піхви і, при наявності крові, необхідно провести термінову лапаротомію. Наростання ознак подразнення очеревини і внутрішньої кровотечі є показанням до лапаротомії навіть при негативному результаті пункції.
Якщо перфорацію матки виконано великим розширювачем, кюреткою або з перфораційного отвору вилучено внутрішні органи (кишечник, сальник), показана термінова операція. Лапаротомія обов’язкова у випадку травми матки поза лікувальним закладом (кримінальний аборт). Об’єм оперативного втручання (зашивання перфоративного отвору, видалення частини чи всієї матки, резекція сальника, кишечника) залежить від обсягу і локалізації пошкодження, віку хворої, розвитку інфекції.
Пошкодження шийки матки найчастіше є наслідком грубого зондування і форсованого розширення цервікального каналу без врахування положення матки. При цьому виникає поранення з проникненням в черевну порожнину, іноді в широку зв’язку матки з утворенням гематоми.
Під час перфорації стінки шийки матки розширювачем або зондом після утрудненого введення інструмента відчувається раптове його провалювання, а потім - вільне проникнення на велику глибину. При перфорації з пошкодженням очеревини і утворенням гематоми в широкій зв”язці матки хвора відчуває сильний біль поряд з внутрішньою, інколи зовнішньою, кровотечею із каналу шийки матки. Проникаюче поранення шийки матки діагностують при обережному зондуванні. При підтвердженні діагнозу всі подальші маніпуляції припиняють і хвору ведуть, як при перфорації тіла матки.
Розриви шийки матки при недостатньому анатомічному відновленні часто загоюються вторинним натягом. Внаслідок цього функція кгругової мускулатури в ділянці зовнішнього вічка порушена, а поздовжні м’язи завдяки своєму тонусу привідкривають зовнішнє вічко. В таких випадках виникає виворіт слизової оболонки каналу шийки матки, який називають ектропіоном. Внаслідок потрапляння в цервікальний канал піхвового вмісту створюються умови для постійного хімічного подразнення, оскільки в каналі лужне середовище, а в піхві – кисле. Анатомічні зміни в шийці матки сприяють проникненню в канал шийки матки інфекції з розвитком хронічного ендоцервіциту. При значних розривах шийки матки виникає її деформація, що призводить до появи постійних слизисто-гнійних виділень, іноді - до контактних кровотеч.
Лікування. Лікування при розривах, деформаціях, ектропіоні шийки матки завжди починають з протизапальної терапії: спринцювання, ванночки, зрошення піхви антисептичними розчинами (0,02 % хлоргексидину біглюконат, калію перманганат 1:10000, риванол, фурацилін 1:5000, хлорофіліпт, рекутан, сальвін та ін.), введення піхвових тампонів з маззю Вишневського, вульнузаном, 10 % мірамістиновою маззю, йоддицерином. Після ліквідації явищ запалення, залежно від ступеня вираження деформації шийки матки, виконують діатермоконізацію, кріодеструкцію або оперативне лікування. Перед лікуванням обов'язково слід провести цитологічне дослідження, кольпоскопію, а в деяких випадках - біопсію з наступним гістологічним дослідженням з метою виключення малігнізації.
Прямокишково-піхвові нориці
Прямокишково-піхвові нориці в більшості випадків виникають внаслідок травматичного пошкодження тканин. Це трапляється при патологічних пологах (вузький таз, великий плід, тривале стояння передлеглої частини плоду в одній площині та ін.), оперативних втручаннях в пологах (накладання акушерських щипців, плодоруйнівні операції), пошкодження суміжних органів під час виконання гінекологічних операцій. Прямокишково-піхвові нориці можуть виникати після перенесеного парапроктиту, променевої терапії.
Клініка. Клінічні прояви прямокишково-піхвових нориць досить характерні. Хворі скаржаться на виділення газів, гною, іноді калу з піхви. При огляді в дзеркалах виявляють гіперемію, набряк, мацерацію слизової оболонки піхви та шкіри зовнішніх статевих органів. На задній стінці піхви знаходять зовнішній отвір нориці різного діаметра – від 1 мм до кількох сантиметрів. Розміри внутрішнього отвору нориці на передній стінці прямої кишки визначають гудзикуватим зондом, введеним через зовнішній отвір нориці, з одночасним пальцевим дослідженням прямої кишки.
Форми нориці можуть бути різноманітними. Найчастіше зустрічаються циліндричні нориці з однаковим діаметром на всій довжині. Лійкоподібні нориці трапляються рідше (діаметр одного з отворів більший від іншого). Інколи нориці мають веретеноподібну форму з однаковим діаметром обох отворів і широкою порожниною.
Діагностика. Прямокишково-піхвові нориці діагностуються без утруднень при нормально сформованому задньому проході. Діагноз грунтується на даних анамнезу, скарг хворої та гінекологічного огляду. Утрудненою є діагностика при дуже малому діаметрі зовнішнього отвору, в цьому випадку застосовують забарвлений розчин, який вводять в пряму кишку, і спостерігають за його виділенням з піхви.
Лікування. Хірургічне. Пластика вимагає досконалого знання анатомії і володіння технічними навичками оперативного втручання.
ТРОМБОЕМБОЛІЧНІ УСКЛАДНЕННЯ В ГІНЕКОЛОГІЇ
В післяопераційний період навіть у соматично здорових жінок розвивається хронічна форма синдрому ДВЗ, що свідчить про наявність преморбідного фону для виникнення тромботичних ускладнень.
Тромбоемболія є порівняно частим ускладненням післяопераційного періоду, особливо у хворих на злоякісні захворювання геніталій.
Патогенез. Факторами, які сприяють розвитку тромбоемболії, є флебіти, тромбози і тромбофлебіти тазу та нижніх кінцівок. Основним джерелом тромбоемболії є тромби, сформовані в великих судинах, зокрема, в системі нижньої порожнистої вени. Це ускладнення виникає, як правило, раптово внаслідок відриву тромба від стінки тазових вен. Завдяки наявності великої кількості венозних сплетень та анастомозів при тромбофлебіті вен тазу можуть не спостерігатися виражені розлади кровообігу. Розвитку тромбозів та тромбоемболії сприяють значна крововтрата, серцева недостатність, дегідратація, обмеженість рухів, ендокардит, атеросклероз. Найчастіше це ускладнення виникає на 3–6 добу після операції. Для проведення ефективної профілактики необхідні своєчасне виявлення і лікування тромбофлебітів. Хворій призначають строгий ліжковий режим, підвищене положення кінцівок, антибіотики широкого спектра дії, прямі та непрямі антикоагулянти, середники, які покращують реологічні властивості крові. Доцільно приймати гепарин по 5-10000 ОД чотири рази на добу внутрішньошкірно, а після відновлення перистальтики – аспірин по 0,5 – 1,0 г на добу, ескузан по 15 крапель 3 рази на добу, пелентан, синкумар, дикумарин, неодикумарин, фенілін. Антикоагулянти застосовують під контролем протромбінового індексу, який не повинен знижуватися менше 40 %, відміну проводять поступово шляхом зменшення їх дози під постійним контролем згортальної системи крові. Доцільно призначити антигістамінні засоби (димедрол, тавегіл, супрастин, кларитин, піпольфен, алергодил), глюкокортикоїди (преднізолон, гідрокортизон, дексаметазон). З метою профілактики тромботичних ускладнень необхідно підтримувати необхідний об’єм циркулюючої крові, гематокрит в межах 35–45 %, нормальну в’язкість та показники згортальної системи крові.
Найбільш небезпечним ускладненням післяопераційного періоду є тромбоемболія магістральних судин (легеневої або мезентеріальної артерії).
Клінічна картина. Тромбоз і тромбоемболія судин брижі клінічно проявляються ознаками "гострого живота". Клінічна картина тромбоемболії легеневої артерії в 25 % випадків супроводжується шоком, в 10 % - інфарктом легені. Найчастіше емболія легеневих судин виникає внаслідок відриву тромба від стінки судин нижніх кінцівок, малого тазу, іноді з правої половини серця.
Ознаки тромбоемболії виникають раптово: хвору турбують виражена задишка, сильний загрудинний біль, артеріальна гіпотензія, тахікардія, аритмія, блідість або ціаноз шкірних покривів, іноді втрата свідомості. Розвиваються ознаки легеневого серця і правошлуночкової недостатності, набухання шийних вен, ритм галопу, підвищується центральний венозний тиск. Далі розвиваються ознаки інфаркту легень: кашель, кровохаркання, виражений плевральний біль. Визначаються шум тертя плеври, ознаки набряку легень.
Діагностика. Діагноз тромбоемболії легеневої артерії та її гілок встановлюють на основі таких ознак:
1. Даних анамнезу про наявність можливого джерела тромбоемболії (хронічної серцевої недостатності, варикозної хвороби, тромбофлебіту, вроджених та набутих вад серця, миготливої аритмії.
2. Ознак емболії легеневих судин (раптової задишки, різкого болю, тахікардії, артеріальної гіпотензії, втрати свідомості, ознак легеневого серця та правошлуночкової недостатності).
3. Ознак інфаркту легені (кашлю, кровохаркання, плеврального болю, шуму тертя плеври, набряку легень).
При рентгенологічному дослідженні виявляють збільшену тінь легеневої артерії, підвищена прозорість легеневої тканини, клиноподібне затемнення в ділянці інфаркту легені, випіт в плевральну порожнину. На електрокардіограмі спостерігаються різко виражена правограма, сплощення або інверсія зубця Т в другому та третьому відведеннях, блокада правої ніжки пучка Гіса. Лабораторні дослідження не мають достатньої діагностичної цінності.
Лікування. Інтенсивна терапія тромбоемболічних ускладнень повинна бути комплексною і включати патогенетичні та симптоматичні засоби. При тромбоемболії магістральних судин легеневої артерії та мезентеріальних артерій призначають антикоагулянтна та фібринолітична терапію. Гепарин призначають по 10-15000 ОД через кожних 4 години внутрішньовенно під постійним контролем часу згортання крові переходять на внутрішньошкірне введення препарату, дозу поступово зменшують під контролем показників згортання крові. Стрептокіназу вводять внутрішньовенно в кількості 250000 ОД в 200 мл ізотонічного розчину натрію хлориду зі швидкістю 30 крапель за хв, а потім - з розрахунку 100000 ОД за годину протягом 4-12 годин. Можна застосовувати фібринолізин по 20000 ОД з 10000 ОД гепарину через кожних 4 – 6 годин. Гепаринотерапія триває 5-7 діб під контролем згортальної системи крові з наступним переходом на непрямі антикоагулянти (аспірин 1,0-1,5 г на добу, ескузан 20-30 крапель на добу). При кровотечі для нейтралізації гепарину застосовують 1 % розчин протаміну сульфату до її припинення. Непрямі антикоагулянти використовують протягом кількох тижнів під контролем протромбінового індексу, який знижують до 60-40 %. При появі підвищеної кровоточивості призначають препарати кальцію, аскорбінову кислоту, рутин, вікасол. При тромбоемболії легеневої артерії застосовують інгаляцію зволоженого кисню. Для нормалізації артеріального тиску використовують симпатоміметики (мезатон, ефедрин). З метою купірування больового синдрому призначають анальгетики, спазмолітики. Для зменшення ознак правошлуночкової серцевої недостатності застосовують серцеві глікозиди.
Радикальне лікування тромбоемболії легеневих артерій полягає в емболектомії. Таке оперативне втручання вимагає відповідної кваліфікації спеціалістів та спеціальної апаратури.


